
已知Br2+2Fe2+=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2,Cl2+2Br-=2Cl-+Br2请判断I2、Br2、Cl2、Fe3+ 的氧化性由强到弱的顺序是( )
|
科目:高中化学 来源: 题型:
科目:高中化学 来源:不详 题型:单选题
| A.I2>Br2>Cl2>Fe3+ | B.Cl2>Br2>I2>Fe3+ |
| C.Fe3+>I2>Br2>Cl2 | D.Cl2>Br2>Fe3+>I2 |
科目:高中化学 来源:2011-2012学年甘肃省临夏河州中学高一(上)期中化学试卷(解析版) 题型:选择题
科目:高中化学 来源: 题型:单选题
科目:高中化学 来源: 题型:
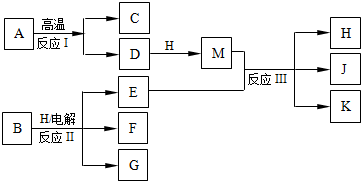
科目:高中化学 来源:学习周报 化学 人教课标高一版(必修1) 2009-2010学年 第19~26期 总第175~182期 人教课标版 题型:022
按要求完成下列问题.
(1)在Fe2+、Al3+、H+、Cl-、S2-、SO32-等粒子中,只有氧化性的是________,只有还原性的是________,既有氧化性又有还原性的是________.
(2)在反应FeO+HNO3→Fe(NO3)3+NO↑+H2O(未配平)中,还原剂是________,氧化产物是________,还原产物是________.HNO3表现出的性质是________.如果有1 mol FeO被氧化,则被还原的HNO3的物质的量为________mol.
(3)已知下列反应:①2Fe3++2I-![]() 2Fe2++I2;②Br2+2Fe2+
2Fe2++I2;②Br2+2Fe2+![]() 2Fe3++2Br-;③Cl2+2Br-
2Fe3++2Br-;③Cl2+2Br-![]() Br2+2Cl-.由此推出Fe3+、Br2、I2、Cl2的氧化性由强到弱的顺序是________.
Br2+2Cl-.由此推出Fe3+、Br2、I2、Cl2的氧化性由强到弱的顺序是________.
科目:高中化学 来源:物理教研室 题型:022
(1)2Fe3++2I-====2Fe2++I2
(2)2Fe2++Br2====2Fe3++2Br-
(3)2Br-+Cl2====2Cl-+Br2
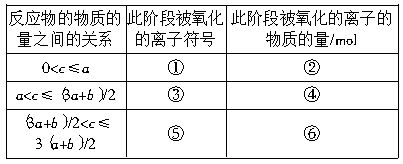
现有某混合溶液中含amolFeI2和bmolFeBr2,向该混合液中逐渐通入cmolCl2,试根据以上化学原理分析,确定当下列物质的量的离子被氧化时,通入Cl2的物质的量的取值范围:
(1)当只有I-被氧化时,c的取值范围为多少?
(2)当有Fe2+被氧化时,c的取值范围为多少?
(3)当有Br-被部分氧化时,c的取值范围是多少?
科目:高中化学 来源: 题型:
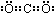
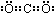
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com