
用0.1mol?L-1的氢氧化钠滴定0.10mol?L-1的醋酸,滴定过程中不可能出现的结果是( )
|
科目:高中化学 来源:不详 题型:单选题
| A.c(Na+)>c(CH3COO-),c(OH-)>c(H+) |
| B.c(CH3COO-)>c(Na+),c(OH-)>c(H+) |
| C.c(Na+)=c(CH3COO-),c(OH-)=c(H+) |
| D.c(CH3COO-)>c(Na+),c(H+)>c(OH-) |
科目:高中化学 来源:2011年浙江省杭州市萧山区高考化学模拟试卷(八)(解析版) 题型:选择题
科目:高中化学 来源:物理教研室 题型:058
A组问题:
(1)指出所选用的试剂(写编号)________。
(2)实验过程中有关反应的离子方程式________。
(3)简述你的操作步骤。
B组问题:
(1)试说明不能测定的原因________。
(2)指出需要补加的试剂名称________。
(3)简述你的操作步骤。
科目:高中化学 来源: 题型:058
在一种烧碱溶液中混有少量纯碱(杂质浓度〈0.1mol•L-1)。某同学欲测定其中氢氧化钠的物质的量浓度。现有的药品和仪器有:药品:①0.10mol•L-1盐酸 ②0.10mol•L-1Ba(OH)2溶液 ③0.10mol•L-1BaCl2溶液④酚酞试液 ⑤甲基橙试液仪器:①铁架台(带滴定管夹) ②烧杯 ③酸、碱式滴定管 ④锥形瓶 ⑤玻璃棒 ⑥过滤装置根据现有的药品和仪器(量和规格均能满足要求),你认为能测定就只回答A组问题,认为不能测定就只回答B组问题。
A组问题:
(1)指出所选用的试剂(写编号)________。
(2)实验过程中有关反应的离子方程式________。
(3)简述你的操作步骤。
B组问题:
(1)试说明不能测定的原因________。
(2)指出需要补加的试剂名称________。
(3)简述你的操作步骤。
科目:高中化学 来源: 题型:
| a(V2-V1) |
| V |
| a(V2-V1) |
| V |
科目:高中化学 来源: 题型:
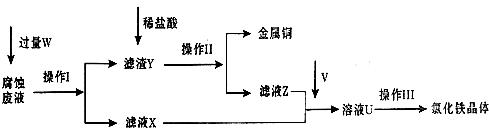
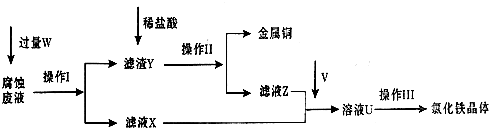
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下,请回答下列问题:
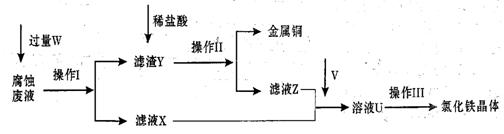
(1)请写出FeCl3溶液与铜反应的离子方程式: ;操作Ⅰ加入的试剂W是 。
(2)操作Ⅱ之前最好加入适量稀盐酸,某同学用10mol• L-1 的浓盐酸配制250mL 1mol• L-1 的稀盐酸,并进行有关实验。
①需要量取浓盐酸 mL。
②配制该稀盐酸时除量筒、烧杯、玻璃棒外,还必须用到的仪器有 、 。
③用已知浓度的氢氧化钠溶液滴定稀盐酸,滴定过程中眼睛应注视 ,实验时未用标准液润洗滴定管,测得锥形瓶中待测液的浓度 实际浓度。(填“>”、“<”或“=”)。
(3)操作Ⅲ前需要通入气体V,请写出实验室制取气体V的化学方程式: ,该反应中 是氧化剂。
(4)操作Ⅲ应在HCl气流氛围中进行,其原因是 。
(5)若通入的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质 。请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足 (简要说明实验步骤、现象和结论)。
供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水。
(6)若向氯化铁溶液中加入一定量石灰水,调节溶液pH,可得红褐色沉淀。该过程中调节溶液的pH为5,则金属离子浓度为 。(己知:Ksp[Fe(OH)3]= 4.0×10-38)
科目:高中化学 来源:不详 题型:问答题
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
科目:高中化学 来源: 题型:解答题
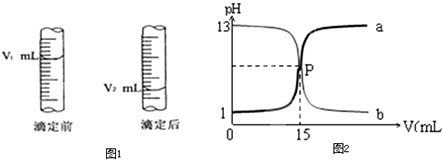
 (相对分子质量为180).
(相对分子质量为180).| 滴定次数 | 0.1mol/L盐酸读数/mL | |
| 滴定前 | 滴定后 | |
| 1 | 0.00 | 17.98 |
| 2 | 1.56 | 16.58 |
| 3 | 0.22 | 15.20 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com