
科目:高中化学 来源:2012-2013学年云南省昆明三中、滇池中学高一(上)期末化学试卷(三)(解析版) 题型:选择题
科目:高中化学 来源:2009-2010学年广东省佛山市南海区大沥高级中学高二(下)期中化学试卷(文科)(解析版) 题型:选择题
科目:高中化学 来源: 题型:
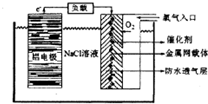 铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.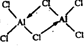

| ||
| ||
科目:高中化学 来源: 题型:
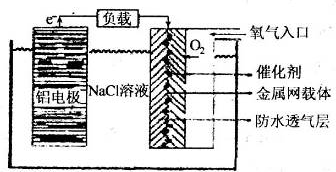
科目:高中化学 来源: 题型:阅读理解
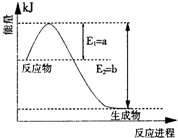
| 催化剂 |
| 高温高压 |
| ||
科目:高中化学 来源: 题型:
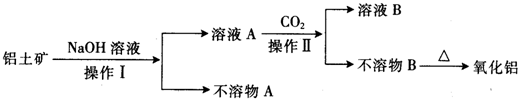
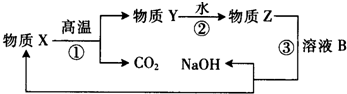
科目:高中化学 来源: 题型:单选题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com