
下列说法中正确的是( )
|
科目:高中化学 来源:2012-2013学年湖南师大附中高二(上)期中化学试卷(解析版) 题型:选择题

科目:高中化学 来源:不详 题型:单选题
| A.如果盐酸的浓度是醋酸的两倍,则盐酸中的H+浓度也是醋酸中的两倍 | ||
B.将NaOH溶液和氨水各稀释一倍,两者的OH-浓度均减小到原来的
| ||
| C.中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 | ||
| D.弱电解质溶液的导电能力也可能比强电解质溶液的强 |
科目:高中化学 来源:2012-2013学年山东省聊城市莘县莘州中学高二(上)期中化学试卷(解析版) 题型:选择题

科目:高中化学 来源:不详 题型:单选题
| A.制取TiO2可用TiCl4加大量水,同时加热:TiCl4+(x+2)H2O(过量)?TiO2?xH2O+4HCl,所得的TiO2?H2O经焙烧得TiO2 |
| B.将NaOH溶液和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的二分之一 |
| C.如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍 |
| D.物质的量相同的磷酸钠溶液和磷酸溶液中所含的PO43-量相同 |
科目:高中化学 来源: 题型:
 将V1 mL 1.00mol?L-1 盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列说法正确的是( )
将V1 mL 1.00mol?L-1 盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列说法正确的是( )科目:高中化学 来源: 题型:
25 ℃时,在20 mL的盐酸中,逐滴加入0.2 mol·L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是
A.滴加前盐酸的物质的量浓度为0.1 mol·L-1
B.B点的横坐标a=10
C.A、B间的任一点,溶液都有c(Cl-)>c(NH4+)> c (H+)> c(OH-)
D.如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定小于C点的pH
科目:高中化学 来源:2010年山东省威海市高三第二次模拟考试(理科综合)化学部分 题型:单选题
25 ℃时,在20 mL的盐酸中,逐滴加入0.2 mol·L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是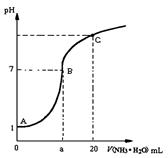
A.滴加前盐酸的物质的量浓度为0.1 mol·L-1
B.B点的横坐标a=10
C.A、B间的任一点,溶液都有c(Cl-)>c(NH4+)> c (H+)> c(OH-)
D.如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定小于C点的pH
科目:高中化学 来源:不详 题型:单选题

科目:高中化学 来源: 题型:
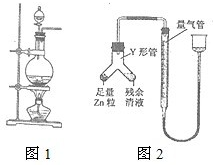 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com