
根据图回答,下列说法正确的是( )
 |
科目:高中化学 来源:2011年北京市大兴区高考化学二模试卷(解析版) 题型:选择题
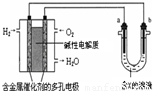
 O2(g)+2e-+2H+=H2O
O2(g)+2e-+2H+=H2O科目:高中化学 来源:2011年湖北省黄冈市英山县复读中心高考化学模拟试卷(4月份)(解析版) 题型:选择题


科目:高中化学 来源:不详 题型:单选题
| A.此装置用于铁表面镀铜时,a为铁 | ||
| B.此装置用于电镀铜时,硫酸铜溶液的浓度不变 | ||
C.燃料电池中正极反应为
| ||
| D.若a为粗铜,b为纯铜,该装置可用于铜的精炼 |

科目:高中化学 来源: 题型:
 已知H2B为二元弱酸,请回答下列问题:
已知H2B为二元弱酸,请回答下列问题:| 溶解 |
| 溶解 |
科目:高中化学 来源:大兴区二模 题型:单选题
| A.若a为粗铜,b为纯铜,X为CuSO4,该装置可用于铜的精炼 | ||
| B.若a为纯铁,b为纯铜,X为CuSO4 该装置用于铁表面镀铜 | ||
C.燃料电池中正极反应为:
| ||
| D.当X为NaCl时,b极上产生的气体能使湿润的淀粉KI试纸变蓝 |

科目:高中化学 来源: 题型:
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g) + 3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
△H=-49.0 kJ·mol-1。某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)
回答下列问题:
(1)该反应在0~8 min内CO2的平均反应速率是 mol/(L•min)。
(2)该反应的平衡常数K= 。
(3)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是 。若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是
(4)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
科目:高中化学 来源:2013届山东省潍坊市高二寒假作业化学(二)试卷 题型:填空题
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g) + 3H2(g) 
 CH3OH(g)
+H2O(g)
CH3OH(g)
+H2O(g)
△H=-49.0 kJ·mol-1。某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)

回答下列问题:
(1)该反应在0~8 min内CO2的平均反应速率是 mol/(L•min)。
(2)该反应的平衡常数K= 。
(3)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是 。若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是
(4)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
科目:高中化学 来源: 题型:阅读理解
 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由 ]对人体健康是十分有益的,然而,市场上经常会出现价格低廉的植物油,其中的亚油酸含量很低.下列关于亚油酸的说法中不正确的是
]对人体健康是十分有益的,然而,市场上经常会出现价格低廉的植物油,其中的亚油酸含量很低.下列关于亚油酸的说法中不正确的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com