
| 工业上生产MnO2和Zn的主要反应有:①MnO2(矿石)+ZnS+2H2S4=MnSO4+ZnSO4+S+2H2O ②MnSO4+ZnSO4+2H2O
|
科目:高中化学 来源:2010-2011学年河南省商丘市高三第二次模拟考试(理综)化学部分 题型:选择题
工业上生产MnO2和Zn的主要反应有:
①MnO2(矿石)+ZnS+2H2S4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4 下列说法正确的是
MnO2+Zn+2H2SO4 下列说法正确的是
A.①中MnO2和H2SO4都是氧化剂 B.①中析出32gS时转移1mol电子
C.②中MnSO4发生氧化反应 D.②中生成的Zn在阳极析出
科目:高中化学 来源:商丘二模 题型:单选题
| ||
| A.①中MnO2和H2SO4都是氧化剂 |
| B.①中析出32gS时转移1mol电子 |
| C.②中MnSO4发生氧化反应 |
| D.②中生成的Zn在阳极析出 |
科目:高中化学 来源:2011年河南省商丘市高考化学二模试卷(解析版) 题型:选择题
 MnO2+Zn+2H2SO4 下列说法正确的是( )
MnO2+Zn+2H2SO4 下列说法正确的是( )科目:高中化学 来源: 题型:单选题
 MnO2+Zn+2H2SO4 下列说法正确的是
MnO2+Zn+2H2SO4 下列说法正确的是科目:高中化学 来源: 题型:
工业上生产MnO2和Zn的主要反应有:
①MnO2(矿石)+ZnS+2H2S4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4 下列说法正确的是
MnO2+Zn+2H2SO4 下列说法正确的是
A.①中MnO2和H2SO4都是氧化剂 B.①中析出32gS时转移1mol电子
C.②中MnSO4发生氧化反应 D.②中生成的Zn在阳极析出
科目:高中化学 来源: 题型:
工业上生产MnO2和Zn的主要反应有:
①MnO2(矿石)+ZnS+2H2S4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2OMnO2+Zn+2H2SO4 下列说法正确的是
A.①中MnO2和H2SO4都是氧化剂 B.①中析出32gS时转移1mol电子
C.②中MnSO4发生氧化反应 D.②中生成的Zn在阳极析出
科目:高中化学 来源: 题型:
| ||
科目:高中化学 来源: 题型:填空题
(18分)MnO2和Zn是制造干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)联合生产MnO2和Zn的工艺流程如下图所示:
(1)操作I用到硅酸盐材质的仪器有烧杯、玻璃棒和_______ _____(填仪器名称)。
(2)稀硫酸浸泡时反应的离子方程式为_______________________________________;该反应中若析出19.2g单质A,共转移____________mo1电子。浸泡时反应速率较慢,下列措施不能提高浸泡时反应速率的是________(填代号)。
a.将矿石粉碎
b.提高浸泡温度
c.适当增大硫酸浓度
d.改变软锰矿与闪锌矿的比例
(3)由硫酸锰溶液可得到固体碳酸锰,然后在空气中煅烧碳酸锰制备MnO2。已知: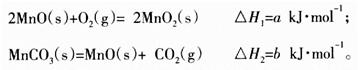
写出碳酸锰在空气中煅烧生成MnO2的热化学方程式_________________________。
(4)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如下图所示:
①a应与直流电源的_________(填“正”或“负”)极相连。.
②电解过程中氢离子的作用是______________和_____________;若转移的电子数为 个,左室溶液中
个,左室溶液中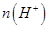 的变化量为________________。
的变化量为________________。
科目:高中化学 来源:不详 题型:填空题



 个,左室溶液中
个,左室溶液中 的变化量为________________。
的变化量为________________。科目:高中化学 来源:不详 题型:填空题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com