
下列递变规律中,正确的是( )
|
科目:高中化学 来源:2009-2010学年浙江省温州市十校联考高二(上)期末化学试卷(解析版) 题型:选择题
科目:高中化学 来源:不详 题型:单选题
| A.还原性:I->Br->Cl- |
| B.热稳定性:HI>HBr>HCl |
| C.碱性:Al(OH)3>Mg(OH)2>NaOH |
| D.非金属性:P>S>Cl |
科目:高中化学 来源:不详 题型:单选题
| A.氧化性:Na+<K+<Rb+<Cs+ |
| B.卤素氢化物的稳定性随核电荷数的递增依次增强 |
| C.在卤素的氢化物中,HI的还原性最强 |
| D.碱金属元素随核电荷数的递增,熔沸点依次升高 |
科目:高中化学 来源:不详 题型:填空题

| | HF | HCl | HBr | HI |
| 键能/kJ·mol-1 | 568.6 | 431.8 | 365.7 | 298.7 |
| 键长/pm | 92 | 127.6 | 141.0 | 162 |
科目:高中化学 来源: 题型:
根据元素周期表及周期律的知识回答下列问题:
(1)与钠同周期且单质熔点最高的元素位于周期表的第_________周期第_________族。
(2)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H22NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
(3)元素周期表中元素的性质存在递变规律,下列比较正确的是________。
a.离子半径:Na+>Mg2+>S2->Cl-
b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl
d. 还原性:PH3>H2S>HCl>HF
(4)第三周期元素的气态原子失去最外层一个电子所需能量(设为E)如下图所示:
① 同周期内,随着原子序数的增大,E值变化的总趋势是__________________。
② 根据上图提供的信息,试推断E氟_______E氧(填“>”“<”或“=”)。
科目:高中化学 来源:2010年上海市青浦高中5月高二化学试题 题型:填空题
根据元素周期表及周期律的知识回答下列问题:
(1)与钠同周期且单质熔点最高的元素位于周期表的第_________周期第_________族。
(2)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H2 2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
(3)元素周期表中元素的性质存在递变规律,下列比较正确的是________。
a.离子半径:Na+>Mg2+>S2->Cl-
b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl
d.还原性:PH3>H2S>HCl>HF
(4)第三周期元素的气态原子失去最外层一个电子所需能量(设为E)如下图所示:
①同周期内,随着原子序数的增大,E值变化的总趋势是__________________。
②根据上图提供的信息,试推断E氟_______E氧(填“>”“<”或“=”)。
科目:高中化学 来源:不详 题型:填空题
 2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
科目:高中化学 来源:2010年上海市5月高二化学试题 题型:填空题
根据元素周期表及周期律的知识回答下列问题:
(1)与钠同周期且单质熔点最高的元素位于周期表的第_________周期第_________族。
(2)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H2 2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
(3)元素周期表中元素的性质存在递变规律,下列比较正确的是________。
a.离子半径:Na+>Mg2+>S2->Cl-
b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl
d. 还原性:PH3>H2S>HCl>HF
(4)第三周期元素的气态原子失去最外层一个电子所需能量(设为E)如下图所示:

① 同周期内,随着原子序数的增大,E值变化的总趋势是__________________。
② 根据上图提供的信息,试推断E氟_______E氧(填“>”“<”或“=”)。
科目:高中化学 来源: 题型:
根据元素周期表及周期律的知识回答下列问题:
(1)与钠同周期且单质熔点最高的元素位于周期表的第_________周期第_________族。
(2)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H22NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
(3)元素周期表中元素的性质存在递变规律,下列比较正确的是??????________。
a.离子半径:Na+>Mg2+>S2->Cl-
b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl
d. 还原性:PH3>H2S>HCl>HF
(4)第三周期元素的气态原子失去最外层一个电子所需能量(设为E)如下图所示:
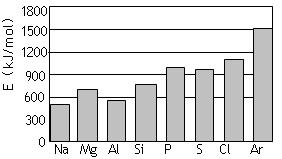
① 同周期内,随着原子序数的增大,E值变化的总趋势是__________________。
② 根据上图提供的信息,试推断E氟_______E氧(填“>”“<”或“=”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com