
关于Na2CO3溶液和NaHCO3溶液,下列说法正确的是( )
|
科目:高中化学 来源:2009-2010学年湖南省长沙一中高三(上)第二次月考化学试卷(解析版) 题型:选择题
科目:高中化学 来源:不详 题型:单选题
| A.用加热的方法区别两种溶液 |
| B.用澄清的石灰水区别两种溶液 |
| C.浓度相同时,Na2CO3溶液的pH大 |
| D.浓度相同时,两溶液的pH相等 |
科目:高中化学 来源:2012年浙江省高考化学模拟试卷(解析版) 题型:选择题
科目:高中化学 来源:浙江模拟 题型:单选题
| A.常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) |
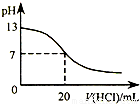
| B.图表示25℃时,用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1NaOH溶液,溶液的pH随加入酸体积的变化 |
| C.在电解食盐水的实验中,若电解后溶液总体积为1L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为12 |
| D.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |

科目:高中化学 来源:2013-2014学年浙江省温州市十校联合体高三上学期期末考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.已知Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-3mo1/L的AgNO3溶液和1×0-3mo1/LK2CrO4溶液混合,会有Ag2CrO4沉淀产生
B.Si—O键的键能大于Si—Cl键的键能,因此SiO2的熔点高于晶体SiCl4的熔点
C.常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为3c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3)
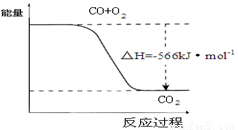
D.已知:2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1,下图可表示由CO生成CO2的反应过程和能量关系
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.已知Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-3mo1/L的AgNO3溶液和1×0-3mo1/LK2CrO4溶液混合,会有Ag2CrO4沉淀产生 |
| B.Si—O键的键能大于Si—Cl键的键能,因此SiO2的熔点高于晶体SiCl4的熔点 |
| C.常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为3c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) |
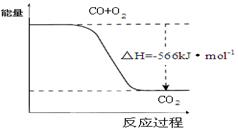
| D.已知:2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1,下图可表示由CO生成CO2的反应过程和能量关系 |
科目:高中化学 来源:不详 题型:单选题
| A.已知Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-3mo1/L的AgNO3溶液和1×0-3mo1/LK2CrO4溶液混合,会有Ag2CrO4沉淀产生 |
| B.Si—O键的键能大于Si—Cl键的键能,因此SiO2的熔点高于晶体SiCl4的熔点 |
| C.常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为3c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) |
| D.已知:2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1,下图可表示由CO生成CO2的反应过程和能量关系 |

科目:高中化学 来源:浙江省模拟题 题型:单选题

科目:高中化学 来源: 题型:
下列说法正确的是:( )
A.等物质的量浓度的各溶液 pH 关系为:pH(CH3COONa)>pH(Na2CO3)
B.NaHCO3和 Na2CO3混合溶液中,一定存在:
c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
C. 0.1mol/LCH3COONa溶液与0.15mol/LHCl等体积混合:c(Cl-)>c(H+)>c(Na+)>
c(CH3COO-)>c(OH-)
D.将等物质的量的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O4-)+c(H2C2O4)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com