
下列关系的表述中,正确的是( )
|
科目:高中化学 来源:2009-2010学年安徽省马鞍山二中高二(下)期中化学试卷(理科)(解析版) 题型:选择题
科目:高中化学 来源:2012年北京市东城区普通高中示范校高考化学模拟试卷(一)(解析版) 题型:选择题
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol?L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-) |
| B.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1 |
| C.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等 |
| D.0.1mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
科目:高中化学 来源: 题型:
下列关系的表述中,正确的是
A.0.1mol?L-1NaHSO4溶液中:c(Na+)+ c(H+)= c(SO42-)+c(OH-)
B.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1∶1
C.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等
D.0.1mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
科目:高中化学 来源: 题型:
下列表述正确的是 ( )
A.0.1mol?L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B.0.1mol?L-1CH3COONa溶液中:c(Na+)=c(CH3COO-)+c(OH-)
C.浓度均为0.1mol?L-1的CH3COONa、NaOH和Na2CO3三种溶液的pH大小顺序:
pH(NaOH)>pH(Na2CO3)>pH(CH3COONa)
D.向0.1mol?L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:
c(CH3COO-)>c(Na+)>c(OH-)=c(H+)
科目:高中化学 来源: 题型:
下列表述正确的是 ( )
A.0.1mol·L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B.0.1mol·L-1CH3COONa溶液中:c(Na+)=c(CH3COO-)+c(OH-)
C.浓度均为0.1mol·L-1的CH3COONa、NaOH和Na2CO3三种溶液的pH大小顺序:
pH(NaOH)>pH(Na2CO3)>pH(CH3COONa)
D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:
c(CH3COO-)>c(Na+)>c(OH-)=c(H+)
科目:高中化学 来源: 题型:
科目:高中化学 来源: 题型:
现有常温下的0.1mol·L-1纯碱溶液。
(1)你认为该溶液呈碱性的原因是(用离子方程式表示): ①
为证明你的上述观点,请设计一个简单的实验,简述实验过程: ②
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO2-3 离子不超过其总量的10%。请你设计实验证明该同学的观点是否正确。 ③
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是
④
A.c(Na+)=2c(CO2-3 ) B.c(CO2-3 )>c(OH-)>c(HCO-3)>c(H2CO3)
C.c(CO2-3 )+c(HCO-3)=0.1mol·L-1 D.c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3)
科目:高中化学 来源:2013-2014学年上海市十三校高三12月联考化学试卷(解析版) 题型:选择题
25℃时。有c(CH3COOH)+ c(CH3COO-)=0.1mol/L的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-) 与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述中正确的是。
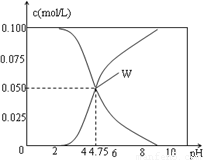
A. pH=5.5的溶液中c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点所表示的溶液中c(Na+) + c(H+)=c(CH3COO-)+c(OH-)
C. pH=3.5的溶液中: c(Na+) + c(H+)-c(OH-)+c(CH3COOH)=0.1mol/L
D.向W点所表示的1L溶液中通入0.05molHCl气体(溶液的体积变化可忽略):c(H+)=c(OH-)+c(CH3COOH)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com