
某温度下,Na2CO3饱和溶液中溶质的质量分数为a%,向其中加入m mol Na2CO3?10H2O,或者n mol Na2CO3,可析出相同质量的Na2CO3?10H2O,则( )
|
科目:初中化学 来源: 题型:
| A、a%可能是40%,m>n | B、a%可能是40%,m=n | C、a%可能是30%,m>n | D、a%可能是30%,m<n |
科目:初中化学 来源:不详 题型:单选题
| A.a%可能是40%,m>n | B.a%可能是40%,m=n |
| C.a%可能是30%,m>n | D.a%可能是30%,m<n |
科目:初中化学 来源:2009年第十九届“天原杯”全国初中学生化学素质和实验能力竞赛(上海赛区)初赛试卷(解析版) 题型:选择题
科目:初中化学 来源: 题型:


| ||
| ||
科目:初中化学 来源: 题型:解答题
 碳酸钠是一种生活中常见的盐,也是一种重要的化工原料.
碳酸钠是一种生活中常见的盐,也是一种重要的化工原料.科目:初中化学 来源: 题型:
 23、碳酸钠是一种生活中常见的盐,也是一种重要的化工原料.
23、碳酸钠是一种生活中常见的盐,也是一种重要的化工原料.科目:初中化学 来源: 题型:
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g) | NaOH | 31 | 91 | 111 | 129 | 313 | 336 |
| Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
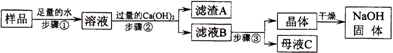
科目:初中化学 来源: 题型:
(1)氯化钠和硝酸钾两种物质的溶解度随温度(0~100℃)的变化见下表:
| 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ | |
| NaCl(g) | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3(g) | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
请分析表格中的数据,回答下列问题:
①若两物质的溶解度相等,此时所对应的温度范围在 之间;
②20℃时,氯化钠饱和溶液的质量分数 硝酸钾饱和溶液的质量分数(填“>”、“<”或“=”);
③某同学欲从含有少量氯化钠的硝酸钾中分离出硝酸钾,他应采取的方法是
。
(2)松花蛋又名皮蛋,微山湖出产的松花蛋因色味具佳享誉齐鲁。松花蛋的制作工艺一般是用水将灰料[主要是生石灰(CaO)、草木灰(成分中含K2CO3)、纯碱(Na2CO3)、食盐(NaCl)等]调成糊状,涂于新鲜鸭蛋,密封保存一段时间后,即可得到松花蛋。
请根据以上信息回答:
①松花蛋腌制中发生的化学反应有 个;
②剥除松花蛋外边灰料后,常常发现蛋壳上有一些坚硬的白色斑点,这斑点的主要成分是 ;
③食用劣质松花蛋时往往有麻涩感,可能的原因是 。
科目:初中化学 来源: 题型:
(1)氯化钠和硝酸钾两种物质的溶解度随温度(0~100℃)的变化见下表:
| 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ | |
| NaCl(g) | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3(g) | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
请分析表格中的数据,回答下列问题:
①若两物质的溶解度相等,此时所对应的温度范围在 之间;
②20℃时,氯化钠饱和溶液的质量分数 硝酸钾饱和溶液的质量分数(填“>”、“<”或“=”);
③某同学欲从含有少量氯化钠的硝酸钾中分离出硝酸钾,他应采取的方法是
。
(2)松花蛋又名皮蛋,微山湖出产的松花蛋因色味具佳享誉齐鲁。松花蛋的制作工艺一般是用水将灰料[主要是生石灰(CaO)、草木灰(成分中含K2CO3)、纯碱(Na2CO3)、食盐(NaCl)等]调成糊状,涂于新鲜鸭蛋,密封保存一段时间后,即可得到松花蛋。
请根据以上信息回答:
①松花蛋腌制中发生的化学反应有 个;
②剥除松花蛋外边灰料后,常常发现 蛋壳上有一些坚硬的白色斑点,这斑点的主要成分是 ;
蛋壳上有一些坚硬的白色斑点,这斑点的主要成分是 ;
③食用劣质松花蛋时往往有麻涩感,可能的原因是 。
科目:初中化学 来源:2012年初中毕业升学考试(福建宁德卷)化学(解析版) 题型:填空题
(13分)K2CO3和KNO3是重要的盐类物质。其溶液应用广泛。
Ⅰ.(1)K2CO3溶液的酸碱性和Na2CO3溶液相似,能使无色酚酞溶液变 色。
(2)K2CO3和KNO3在不同温度时的溶解度如下:
|
温度/℃ |
20 |
30 |
50 |
60 |
80 |
|
|
溶解度/g |
K2CO3 |
110 |
114 |
121 |
126 |
139 |
|
KNO3 |
31.6 |
45.8 |
85.5 |
110 |
169 |
①右图中表示KNO3溶解度曲线的是 (填“甲”或“乙”)。

②20℃时,K2CO3饱和溶液中溶质与溶剂的质量比为 。
Ⅱ.某KNO3样品中含有少量K2CO3,其提纯流程如下:

(1)溶液A加入适量Ca(NO3)2溶液,与溶液中K2CO3恰好完全反应,生成CaCO3沉淀和KNO3,写出该反应的化学方程式: 。
(2)操作a的名称是 。
(3)20℃时溶液C是 (填“饱和溶液”或“不饱和溶液”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com