追踪科学家的足迹
材料1:纯碱的产量是衡量一个国家化学工业发展水平的重要指标.下面是实验室摸拟侯氏制碱法生产原理的主要过程:(1)20℃时,向浓氨水中通入足量的二氧化碳得到NH
4HCO
3饱和溶液;②向NH
4HCO
3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO
3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体放在试管中充分加热,得到Na
2CO
3④向③的滤液中加入食盐细粒,析出NH
4Cl晶体,过滤,得到NH
4Cl.
材料2:四种盐在不同温度下的溶解度表.
温度
盐 溶解度 |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
| NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
| NH4HCO3 |
15.8 |
21.0 |
27.0 |
|
|
| NaHCO3 |
8.1 |
9.6 |
11.1 |
12.7 |
|
| NH4CI |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
试回答下列问题:
(1)在实验室中,你选择的制备C0
2反应的化学方程式为
.在工业生产中,要获得生产纯碱原料CO
2的化学方程式为
.
(2)有人认为侯氏制碱法有以下优点,你认为其中正确的是
.
A.生产过程中部分反应产物可作为原料循环使用
B.副产品是一种氮肥
C.反应都不需要加热,可节约能源
(3)在②中,随着食盐的逐渐加入,溶液变成了NH
4HCO
3和NaCl的混合溶液,析出晶体之前,混合溶液中存在的离子有(用离子符号表示,下同.)
.在③中,将析出的晶体过滤后,溶液中数量减少的离子有
;滤液中仍然存在的离子有
.②中反应的化学方程式为
.
(4)在20℃时,向含NH
4HC0
3 21g的饱和溶液中加入足量食盆.试通过计算说明,随着食盐的逐渐加入,为什么会有NaHC0
3晶体析出,而没有NH4CI晶休析出?理论上能析出多少克NaHCO
3?(友情提示:本小题没有计算过程不得分.可能用到的相对分子质量:NH
4HC0
3:79; NaCl:58.5; NaHC0
3:84,NH
4Cl:53.5).

 克
克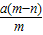 克
克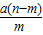 克
克 克
克