
科目: 来源:gzhx 题型:
已知H-H键能为436 kJ/mol,H-N键能为391 kJ/mol,根据热化学方程式:N2(g)+3H2(g)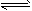 2NH3(g) 2NH3(g) ΔH=-92.4 kJ/mol,则N≡N键的键能是 |
A.431 kJ/mol B.946 kJ/mol C.649 kJ/mol D.869 kJ/mol |
科目: 来源:gzhx 题型:
| 在下列反应中,氧化剂与还原剂的质量之比为1:1的是 |
A.2FeCl2 + Cl2== 2FeCl3 B.3Cl2 + 6NaOH== 5NaCl + NaClO+3H2O C.Cl2 + 2NaOH== NaCl + NaClO+ H2O D.3NO2 + H2O== 2HNO3 + H2O |
科目: 来源:gzhx 题型:
| 某同学按照课本实验要求,用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH 溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。下列说法正确的是 |
|
A.实验过程中热量损失为零 B.图中实验装置缺少环形玻璃搅拌棒 C.烧杯间填满碎纸条的作用是固定小烧杯 D.若将盐酸体积改为60 mL,理论上所求中和热不相等 |
科目: 来源:gzhx 题型:
| 工业品的MnCl2溶液含常有Cu2+、Pb2+等离子,可通过加入过量难溶电解质MnS使其中的Cu2+、Pb2+等离子形成沉淀,以制取纯净MnCl2。由此可推知MnS |
A.具有吸附性 B.溶解度小于CuS、PbS C.溶解度与CuS、PbS相同 D.溶解度大于CuS、PbS |
科目: 来源:gzhx 题型:
| 下列叙述正确的是(NA代表阿伏加德罗常数的值) |
A.2.4g金属镁变为镁离子时失去的电子数为0.1NA B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等 C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com