
科目: 来源:2009-2010学年江苏省南通市如皋市四校联考高二(上)期中化学试卷(解析版) 题型:选择题
 2SO3(g)△H<0,在上述条件下,SO2的转化率约为90%.但是部分发达国家采用高压条件获得SO3,采取加压措施的目的( )
2SO3(g)△H<0,在上述条件下,SO2的转化率约为90%.但是部分发达国家采用高压条件获得SO3,采取加压措施的目的( )查看答案和解析>>
科目: 来源:2009-2010学年江苏省南通市如皋市四校联考高二(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2009-2010学年江苏省南通市如皋市四校联考高二(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2009-2010学年江苏省南通市如皋市四校联考高二(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2009-2010学年江苏省南通市如皋市四校联考高二(上)期中化学试卷(解析版) 题型:选择题
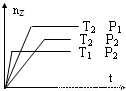
查看答案和解析>>
科目: 来源:2009-2010学年江苏省南通市如皋市四校联考高二(上)期中化学试卷(解析版) 题型:选择题
 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )查看答案和解析>>
科目: 来源:2009-2010学年江苏省南通市如皋市四校联考高二(上)期中化学试卷(解析版) 题型:解答题
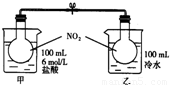
查看答案和解析>>
科目: 来源:2009-2010学年江苏省南通市如皋市四校联考高二(上)期中化学试卷(解析版) 题型:解答题
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol?L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O82-)/mol?L-1 | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t2 |
查看答案和解析>>
科目: 来源:2009-2010学年江苏省南通市如皋市四校联考高二(上)期中化学试卷(解析版) 题型:解答题
 ,下列有关该体系的说法正确的是______.
,下列有关该体系的说法正确的是______.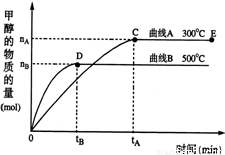
查看答案和解析>>
科目: 来源:2009-2010学年江苏省南通市如皋市四校联考高二(上)期中化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com