
科目: 来源: 题型:阅读理解
 某活动小组的同学对碳酸钠与稀盐酸反应进行了下列探究:
某活动小组的同学对碳酸钠与稀盐酸反应进行了下列探究:
【探究一】向放有一支燃着的蜡烛的烧杯中加适量碳酸钠和盐
酸(如图所示):
(1)蜡烛燃烧变化的现象是: 。
(2)根据该实验现象推测碳酸钠与盐酸反应产生的气体可用于 (写出用途)。
【探究二】利用碳酸钠与盐酸的反应,可否用于验证质量守恒定律进行了探究,实验如下:
|
 如右图所示,在(吸滤)瓶中加入适量的碳酸钠粉
如右图所示,在(吸滤)瓶中加入适量的碳酸钠粉 末,在小试管中加入盐酸。将小试管放入吸滤瓶中,
并用止水夹夹住支管处的橡皮管。称量整个装置的
质量,记录读数。将吸滤瓶倾斜,使小试管中的盐
酸倾倒入瓶中,与碳酸钠粉末反应。可观察到如图二
所示的现象。再次称量整个装置的质量,记录读数。
两次读数 (填“是”或“否”)相等。理由是 。
【探究三】碳酸钠与盐酸反应后剩余溶液的成分探究(假设二氧化碳已完全放出,杂质溶于水,不参加反应且呈中性)。甲、乙两同学分析认为剩余溶液中一定含有氯化钠,可能有盐酸或碳酸钠。为验证是否含有盐酸,他们采用了不同方法进行实验,得到了相同的结论。
查找资料:氯化钠溶液呈中性
| 实验操作 | 实验现象 | 结论 | |
| 甲 | 取样于试管中,滴加 试液[ | 试液变红 | 有盐酸 |
| 乙 | 取样于试管中,逐滴滴加碳酸钠溶液[ |
|
【探究四】某兴趣小组同学向盛有6.0g纯碱样品的烧杯里加入40.0g盐酸,实验测定完全反应后烧杯中剩余物的质量为43.8g,且溶液显酸性。(假设纯碱样品中的杂质不与盐酸反应)求:
(1)产生的二氧化碳的质量为 g。
(2)纯碱样品中碳酸钠的质量(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
“低碳城市”的理念贯穿在上海世博园的建设中。
(1)“低碳城市”的建设减少了二氧化碳气体的排放,能减缓 的程度;自然界中消耗二氧化碳的主要途径是 ;请你写出一种日常生活中符合“低碳经济”理念的做法: 。
(2)法国化学家PaulSabatier采用“组合转化”技术使CO2和H2在催化剂作用下生成CH4和H2O。试写出该反应的化学方程式 。
(3)近来有科学家提出利用“碳捕捉技术”来降低工业生产中二氧化碳的排放量。“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用。常利用足量的NaOH溶液来“捕捉”CO2,过程如下图所示(部分条件及物质未标出)。
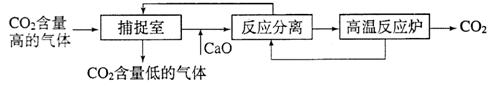 |
①捕捉室中发生反应的化学方程式为: 。
②把CaO放入反应分离室中与H2O反应,请写出该反应的化学方程式: ;利用此反应,氧化钙可用作食品 剂。
③“反应分离”中,得到固体物质的基本操作是 ,该固体是碳酸钙。
④整个过程中,可以循环利用的物质有 。
(4)取10g碳酸钙固体高温加热,一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%,则下列判断正确的是
A.生成了2g二氧化碳
B.剩余固体质量为5g
C.生成了5.6g氧化钙
D.剩余碳酸钙的质量为8g
查看答案和解析>>
科目: 来源: 题型:
下图是常见物质转化关系图(个别产物可能略去),其中A、B常温下均为液态,且组成元素相同;Y为氧化物,Z是紫红色固体。
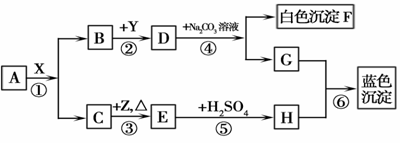
(1)在反应①中,物质X起的可能是 作用。
(2)A是 (填化学式,下同);Z是
(3)反应④、⑤的化学方程式分别为 、
(4)反应①~⑥涉及的基本反应类型共有 种。
查看答案和解析>>
科目: 来源: 题型:
在溶液中较难制得纯净的Fe(OH)2,原因是Fe(OH)2不稳定,在水中只要有一点氧气就极易反应生成红褐色沉淀Fe(OH)3。写出其反应的化学方程式:
。
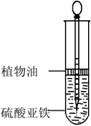
用下面两种精心设计的方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含氧气的蒸馏水配置FeSO4溶液与NaOH溶液,然后反应制备。
a.除去蒸馏水中溶解的氧气,常采用 的方法。
b.如图所示,用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。试管中油层的作用 是 。
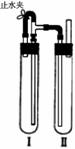
方法二:用如图装置来制备。
a在装置Ι中加入Fe和稀H2SO4,写出其反应的化学方程式 ;在装置Ⅱ中加入NaOH浓溶液。
b为了制得白色Fe(OH)2沉淀,需要下列步骤,其顺序为
①气密性检查 ②气体验纯
③加入试剂塞紧橡皮塞 ④打开止水夹 ⑤夹紧止水夹。
c.写出试管Ⅱ中发生的化学反应方程式
、 。
这样生成的Fe(OH)2沉淀能较长时间保持白色。
 | |||
 | |||
查看答案和解析>>
科目: 来源: 题型:
化学就在我们身边。
(1)下列是与人类的生活密切相关的物质:①石油、②酒精、③汞、④合成橡胶,请选择相应的编号填空.
①实验室中常用的燃料是
②温度计中填充的液态金属
③可做汽车轮胎的材料是
④被称为“工业的血液”的化石燃料是
(2)写出以下物质的化学式
①天然气 ②干冰
查看答案和解析>>
科目: 来源: 题型:
某校课外活动小组的同学们利用水的电解实验探究水的组成,他们量取192.7mL水(水的密度为1.00g/cm3),并向水中加入了7.3g氢氧化钠固体,充分溶解后按右下图所示的装置进行实验,接通电源,当A管收集到22.3mL气体(气体密度为0.09g/L)时,停止实验。请分析回答:
(1)水通电分解的化学反应方程式为:
(2)实验中A管生成的气体质量是 ;
(3)向水中加入氢氧化钠固体的目的是
;
(4)停止实验时剩余“水中”氢氧化钠的质量分数是多少?(列式计算)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com