

科目: 来源:2010-2011学年上海市高三上学期期中考试化学试卷 题型:选择题
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+ B.样品中Fe元素的质量为2.24 g
C.样品中Fe元素的质量为2.49 g D.样品CuO的质量一定为0.80 g
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期期中考试化学试卷 题型:填空题
(8分)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是生成物之一。
⑴ 该反应中的还原剂是_____________。
⑵ 该反应中的还原产物是____________。
⑶ 写出该反应的化学方程式并标出电子转移方向和数目
____________________________________________________________________。
⑷ 若反应过程中转移了0.3 mol电子,则生成水的质量是______________。
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期期中考试化学试卷 题型:填空题
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为 。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(4)由表中两种元素的原子按1︰1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) _。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
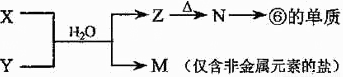
X溶液与Y溶液反应的离子方程式为 ,N→⑥的单质的化学方程式为 。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至 。
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期期中考试化学试卷 题型:填空题
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
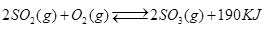
1)该反应所用的催化剂是 (填写化合物名称),该反应450℃时的平衡常数 500℃时的平衡常数(填“大于”、“小于”或“等于”)。
2)该热化学反应方程式的意义是 .
3)下列描述中能表明该反应已达平衡状态的是 。
a.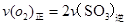 b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
4)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则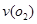 =
mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后, mol<n(SO3)< mol。
=
mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后, mol<n(SO3)< mol。
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期期中考试化学试卷 题型:实验题
实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:

(1)这些装置的连接顺序(按气体左右的方向)是 → →
→ → → → → (填各接口的编号)。
(2)实验时甲橡皮管的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期期中考试化学试卷 题型:实验题
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
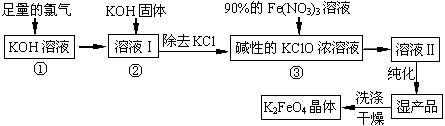
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2 反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式
,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3 、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期期中考试化学试卷 题型:填空题
有机物的结构可用“键线式”简化表示,如:CH3—CH=CH—CH3可表示为 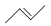 ,有一种有机物X它的键线式如下:
,有一种有机物X它的键线式如下:
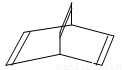
(1) X的分子式为: ;有机物Y是X的同分异构体,且属于芳香族化合物。则Y的结构简式是 。
(2) Y可以与溴水反应,其生成物的结构简式是 ; Y在一定条件下还可生成高分子化合物,该反应的化学方程式: 。
(3) Y在一定条件下还可以与H2生成环状的饱和烃Z,Z的结构简式为 。
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期期中考试化学试卷 题型:实验题
2005年的诺贝尔化学奖颁给了3位在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解反应实际上是在金属烯烃络合物的催化下实现C=C双键两边基团换位的反应。如下图表示了两个丙烯分子进行烯烃换位,生成两个新的烯烃分子——丁烯和乙烯。

现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I和G在不同条件下反应可生成多种化工产品,如环酯J。

请按要求填空:
(1) 写出下列反应的反应类型:
①______________,⑥______________,⑧______________。
(2) 反应②的化学方程式是___________________________________________。
(3) 反应④、⑤中有一反应是与HCl加成,该反应是________(填反应编号),设计这一步反应的目的是_____________________________________________,
物质E的结构简式是_______________________。
(4) 反应⑩的化学方程式是___________________________________________。
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期期中考试化学试卷 题型:填空题
将一生锈的铁片置于稀硝酸中,反应结束后,共收集11.2L NO气体(标况)。溶液中还剩下固体残渣5g,过滤后向浅绿色溶液中通入35.5g氯气,恰好使Fe2+全部氧化,求原铁片的质量和铁锈的百分含量(铁锈成分以Fe2O3计算)。(保留两位小数)
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期期中考试化学试卷 题型:填空题
硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:
① Na2SO4 + 4C →高 温 Na2S + 4CO
② Na2SO4 + 4 CO→高 温 Na2S + 4CO2
(1)现要制取Na2S 7.8克,需要无水芒硝(Na2SO4) g;
(2)若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量范围n的范围是 < n < ;
(3)若在上述反应中消耗的碳单质为1mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y= ;
(4)Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经被部分氧化的硫化钠39.2 g溶于水中,加入足量盐酸,充分反应后,过滤得沉淀9.6g,放出H2S气体1.12L(标准状况),求:39.2g被部分氧化的硫化钠中Na2S的物质的量为 mol;Na2SO3的物质的量为 mol;Na2SO4的物质的量为 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com