

科目: 来源: 题型:
)回收的废旧锌锰于电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如下图所示。
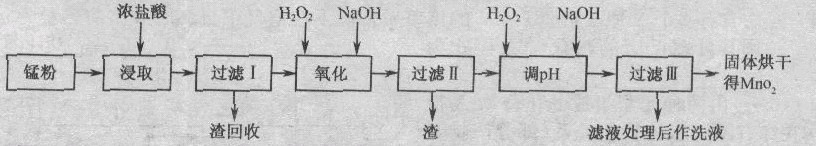
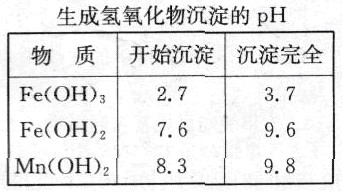
根据上图所示步骤并参考表格数据,回答下列问题。
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等。MnO2与浓盐酸反应的离子方程式为________________________________。
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是__________________________。
(3)过滤I所得滤液经氧化后,需加入NaOH溶
液调节pH约为5.1,其目的是______________________________________。
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离于方程式为__________________________________________。
(5)实验室进行过滤操作时.需要用到的玻璃仪器有___________________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
.碱式氯化铝[Al2(OH)nCl6-n]m (1≤n≤6,m≤10) (商业代 号BAC),是一种比Al2(SO4)3效果更好的净水药剂。以下是用煤矸石(主要含Al2O3,SiO2及少量铁的氧化物)为原料生产碱式氯化铝过程中遇到的情况:
⑴在反应器中加入16%的硫酸和16%的盐酸,在不断搅拌过程中再加入经过焙烧后的煤矸石粉,反应器上部有一条长管子作为反应时气体的排放管。加热至沸腾(102℃)并保持一段时间,期间不断用精密pH试纸在排气管口上方检查排出气体的pH,记录如下:
时间 | 起始 | 14min后 | 30min后 | 75min后 |
pH | <2.0 | =2.5 | <3.5 | =3.5 |
试解释排气管中放出气体的pH变化的原因。如果把排气管加长一倍,排气的pH有无变化?为什么? ,
⑵观察反应器内溶液的颜色(取上面清液观察),在沸腾1h内,溶液逐渐呈黄绿色,以后逐渐转变为淡棕黄色,1.5h后呈棕红色。解释导致颜色变化的原因。
⑶上述反应结束后,冷却,过滤弃渣,然后再加热至100℃,并在不断搅拌的条件下,向溶液慢慢地添加Ca(OH)2至适量,生成大量沉淀。过滤上述溶液,弃渣,得到澄清的BAC稀溶液。将此稀溶液加热蒸发浓缩,又产生白色细晶状沉淀,经化验分析,知此沉淀不是BAC固体,也不是AlCl3晶体或Al(OH)3。问:这是什么物质?为什么此时会有沉淀析出?
⑷铁的化合物和铝的化合物一样也可作净水药剂,此外,溶液中元素Fe还能与CN-形成特定的络合物。某溶液中同时存在Fe(CN)63-和Fe(CN)64-两种离子,H2O2可使它们相互转化,请用离子方程式表示这种转化。
酸性条件:
碱性条件:
查看答案和解析>>
科目: 来源: 题型:
某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓缓地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象。
(1)本实验中生成CO2和SO2的有关反应的化学方程式为:____________________________________;
_______________________________________。
(2)对比分析两组实验,你认为用图一装置实验时,通过SO2不能出现浑浊的原因可能是_________________________________________________________________________。
(3)用图二装置进行实验,以相同速率通入CO2和SO2时,SO2产生浑浊、澄清的现象比CO2快的原因可能是___________________________________________________
______________________________________________________________________。
(4)用图一进行SO2与石灰水反应的实验时,从安全或环境角度考虑,该装置可如何改进?
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3 、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3 + CO2 + H2O = NH4HCO3 ; NH4HCO3 + NaCl = NaHCO3↓+ NH4Cl ; 2NaHCO3
Na2CO3 + CO2↑+ H2O
⑴碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填标号)。
A.碳酸氢钠难溶于水 B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
⑵?某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
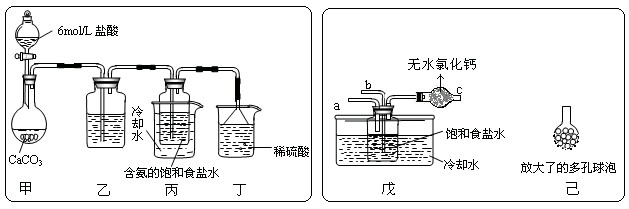
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 。
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
。
⑶?请你再写出一种实验室制取少量碳酸氢钠的方法:
。
查看答案和解析>>
科目: 来源: 题型:
下列实验操作中,错误的是
①用10mL量筒量取6.4mL盐酸;
②切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割;
③配制FeSO4溶液,应先将盐溶解在稀硫酸中,再加水稀释到所需浓度,并加入少量铁屑;
④加热烧杯(瓶)时要垫石棉网,所以在加热前,烧杯(瓶)外壁不必擦干;
⑤不慎接触过多的氨,应及时吸人新鲜的空气和水蒸气,并用大量水冲洗眼睛;
⑥用带橡皮塞的棕色试剂瓶存放浓HNO3。
⑵右图为实验室制H2的装置。若液面刚好不与锌粒接触而又无
酸液可加入,则可以从长颈漏斗中加入适量试剂是
①食盐水 ②苯
③四氯化碳 ④Na2CO3溶液
⑤硫酸铜溶液 ⑥KNO3溶液
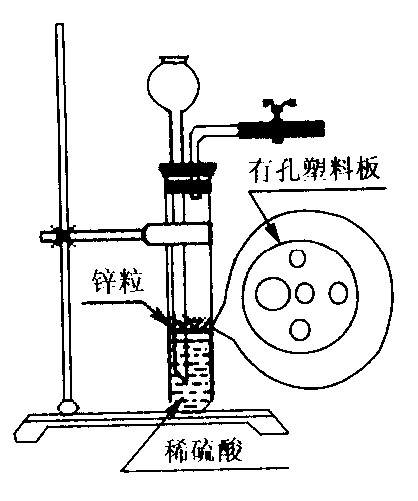
查看答案和解析>>
科目: 来源: 题型:阅读理解
某校化学研究性学习小组的同学在学习了金属的知识后,为了解Cu的常见化合物性质,运用类比学习的思想提出如下的问题,进行探究。请你协助该小组的同学完成下列研究。
【提出问题】
① Cu的金属活泼性小于Al,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
② 通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③ CuO能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
⑴ 解决问题①需用到的药品有CuSO4溶液、 (填试剂),同时进行进行相关实验。
⑵ 解决问题②的实验步骤和现象如下:取98gCu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。据此可推得,A的化学式为 。
⑶ 为解决问题③,设计的实验装置为(夹持及尾气处理装置装置未画出):
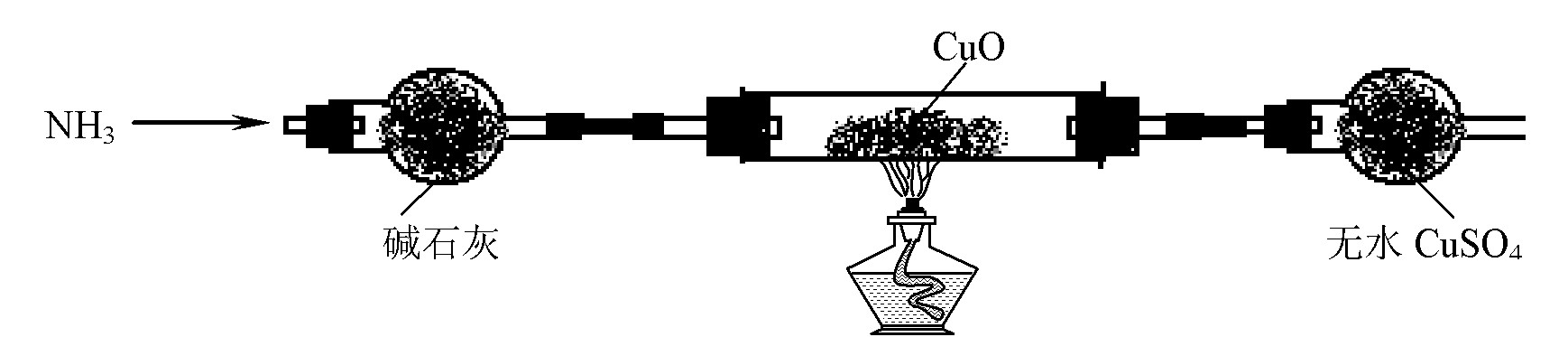
实验中观察到CuO变为红色物质,无水CuSO4变蓝色。同时生成一种无污染的气体。
【实验结论】
⑴ Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是 。
⑵ 根据“实验方案⑵”,得出的+1价Cu和+2价Cu稳定性大小的结论是 ; 。
⑶ CuO能被NH3还原。该反应的化学方程式为 。
【问题讨论】
⑴ 有同学认为NH3与CuO反应中生成的红色物质是Cu,也有同学认为NH3与CuO反应中生成的红色物质是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A ;
查看答案和解析>>
科目: 来源: 题型:
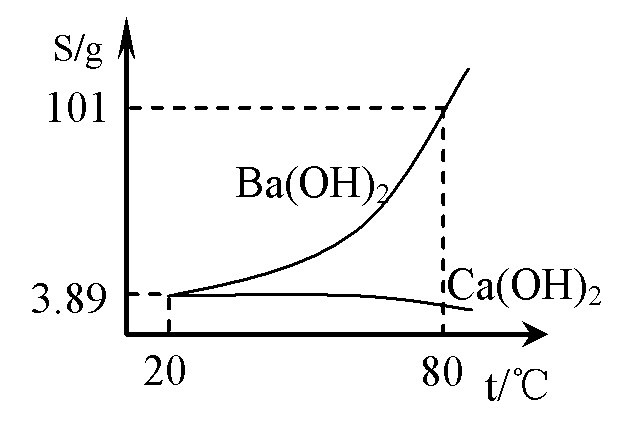
)实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下,请根据要求填空(右图为Ba(OH)2和Ca(OH)2的溶解度曲线):
⑴ 高温灼烧碳酸钡和碳酸钙的混合物,直至分解完全。所需仪器除坩埚、泥三角、玻璃棒、三脚架外还有 ;
⑵ 将灼烧后的固体混合物置于80℃的热水中,制成氢氧化钡的热饱和溶液。为减少Ba(OH)2的损失并除去不溶物应进行的操作是 ;
⑶ 将“⑵”中滤液 并过滤,得到的Ba(OH)2固体溶于水制成溶液。
⑷ 向制得的Ba(OH)2溶液中滴加 (填一种试剂名称),再通入二氧化 碳。当观到 时,即可停止通二氧化碳。
⑸ 滤出碳酸钡沉淀,经洗涤、干燥后即得到纯净的碳酸钡。
查看答案和解析>>
科目: 来源: 题型:
)某同学用如图1所示的装置来探究SO2的性质及有关实验。
(1)实验前应先检验装置的气密性,方法是
(2)实验室用亚硫酸钠固体与硫酸反应制取SO2气体,写出该反应的化学方程式
。
(3)分别将SO2气体通入气体下列C溶液中,请回答下列问题:
①少量SO2通入紫色石蕊试液,现象是 ,继续通入过量的SO2气体,现象是 。
②SO2通入紫红色KMnO4溶液,现象是 ,写出反应的离子方程式 。
③SO2慢慢通入(可以气割气泡通入)澄清石灰水中,现象 。
④SO2通入少量的澄清石灰水中,没有明显现象,产生此现象的原因是
。
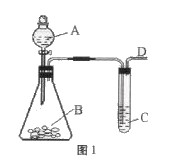

(4)若同学制取的SO2气体中混有CO2气体,请你设计
实验证明混合气体中既有SO2气体,又有CO2气体。
可以选择图2洗气装置设计实验。洗气装置里的溶液是:
A浓硫酸、B氢氧化钠溶液、C硫酸铜溶液、D品红溶液、
E澄清石灰水、F高锰酸钾溶液、G碳酸氢钠溶液。
上述装置的连接顺序是(用字母表示,所给装置可以重复使用,有些装置也可以不用)
。
查看答案和解析>>
科目: 来源: 题型:
在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:
(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物
是
(2)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号
及实验中观察到的现象。
同学正确 | 选用试剂 | 实验现象 |
第一种方法 | ||
第二种方法 |
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子
是 若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,
你认为是否可行? (填可行或不可行)
理由是:
查看答案和解析>>
科目: 来源: 题型:
利用如图所示的装置和其他必要的仪器用品,完成下列实验。
(1)证明氨气具有还原性。已知2NH3+3CuO===N2+3Cu+3H2O。
① 碱石灰的作用是 稀硫酸的作用是 。
② 浓氨水与固体NaOH接触,为什么会逸出大量氨气?
。
③ 证明NH3?具有还原性的实验现象是
。
(2)用吸收了足量氨气的硫酸溶液可以制取少量硫酸亚铁铵晶体。
(NH4)2SO4+FeSO4+6H2O===(NH4)2Fe(SO4)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com