
科目: 来源: 题型:
纳米材料在绝大多数同学眼里都非常神秘。某化学学习小组决定通过查阅有关资料,自己动手实验,制备纳米铁粉。
【实验原理】
⑴用硫酸亚铁、草酸两溶液制备草酸亚铁晶体(溶解度较小)。该反应的化学方程式是 。
⑵焙烧草酸亚铁晶体:FeC2O4·2H2O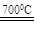 Fe+2CO2↑+2H2O↑
Fe+2CO2↑+2H2O↑
【操作步骤】
⑴草酸亚铁晶体的制备
①现有烧杯、玻璃棒、药匙、滤纸、托盘天平、FeSO4、草酸等实验用品,为配制上述两溶液,缺少的仪器有 。
②若配制的FeSO4溶液略呈黄色,可能的原因是 。
③检验草酸亚铁晶体是否洗净的方法是 。
⑵纳米铁粉的制备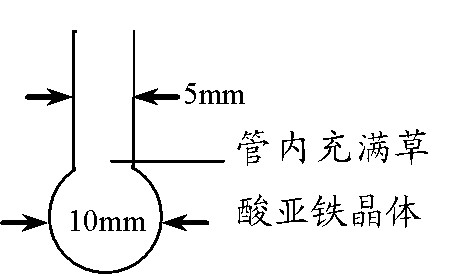
将一根长度约为12 cm~14cm的玻璃管在酒精喷灯上烧制成如图所示形状,向其中加入黄色草酸亚铁晶体。再将管口部分加热拉细,然后在酒精喷灯上均匀加热。当草酸亚铁粉末受热完全变黑,立即将管口拉细的部分放在火焰烧熔封闭,这样便得到了高纯度的纳米铁粉。
①实验中分解产生CO2所起的作用是 。
②指导老师提醒同学们应准确把握玻璃管的烧熔封闭时间。你认为烧熔过早、过晚的后果是 。
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组利用饱和氯水与石灰石的反应,制取较浓的HClO溶液,并对所得溶液中的部分阴离子进行检验。
实验操作 | 实验现象 | |
步骤1 | 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份 | 有少量气泡产生,溶液的黄绿色褪去 |
步骤2 | 将第一份滤液与稀盐酸混合 | 产生大量气泡 |
步骤3 | 将第二份滤液加热 | 溶液变浑浊,且有大量无色气体产生 |
⑴步骤1过滤的目的是__________________________________________。
⑵步骤2、步骤3的实验目的都是 ;为达到该实验目的,还可以采取的方法是 。
⑶请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大: 。
查看答案和解析>>
科目: 来源: 题型:
阿斯匹林(乙酰水杨酸)是由水杨酸和乙酸酐合成的:
+ (CH3CO)2O  + CH3COOH
+ CH3COOH
(水杨酸) (乙酸酐) (阿斯匹林)
在生成乙酰水杨酸的同时,水杨酸分子间也能发生缩合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
① 向150mL干燥锥形瓶中加入2g水杨酸、5mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85~90℃条件下反应5~10min。然后冷却,即有乙酰水杨酸晶体析出。
② 减压过虑,用滤液淋洗锥形瓶,直至所有晶体被收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量交溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③ 将粗产品置于100mL烧杯中,搅拌并缓慢加入25mL饱和碳酸氢钠溶液,加完后继续搅拌2~3分钟,直到没有二氧化碳气体产生为止。过滤,用5~10mL蒸馏水洗涤沉淀,合并滤液于烧杯中,不断搅拌,慢慢加入15mL4mol/L盐酸,将烧杯置于冷水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1~2次,再抽干水分,即得产品。
请回答下列问题:
(1) 第①步中,要控制反应温度在85~90℃,应采用_________ 加热方法。用这种加热方法需要的玻璃仪器有__________。
(2) 在第②步中,用冷水洗涤晶体,其目的是___________________________
(3) 第③步中,加入碳酸氢钠的作用是____________________
加入盐酸的作用是________________________
(4) 如何检验产品中是否混有水杨本?___________________________
查看答案和解析>>
科目: 来源: 题型:
现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、NO3-的相互分离。相应的实验过程可用下图表示: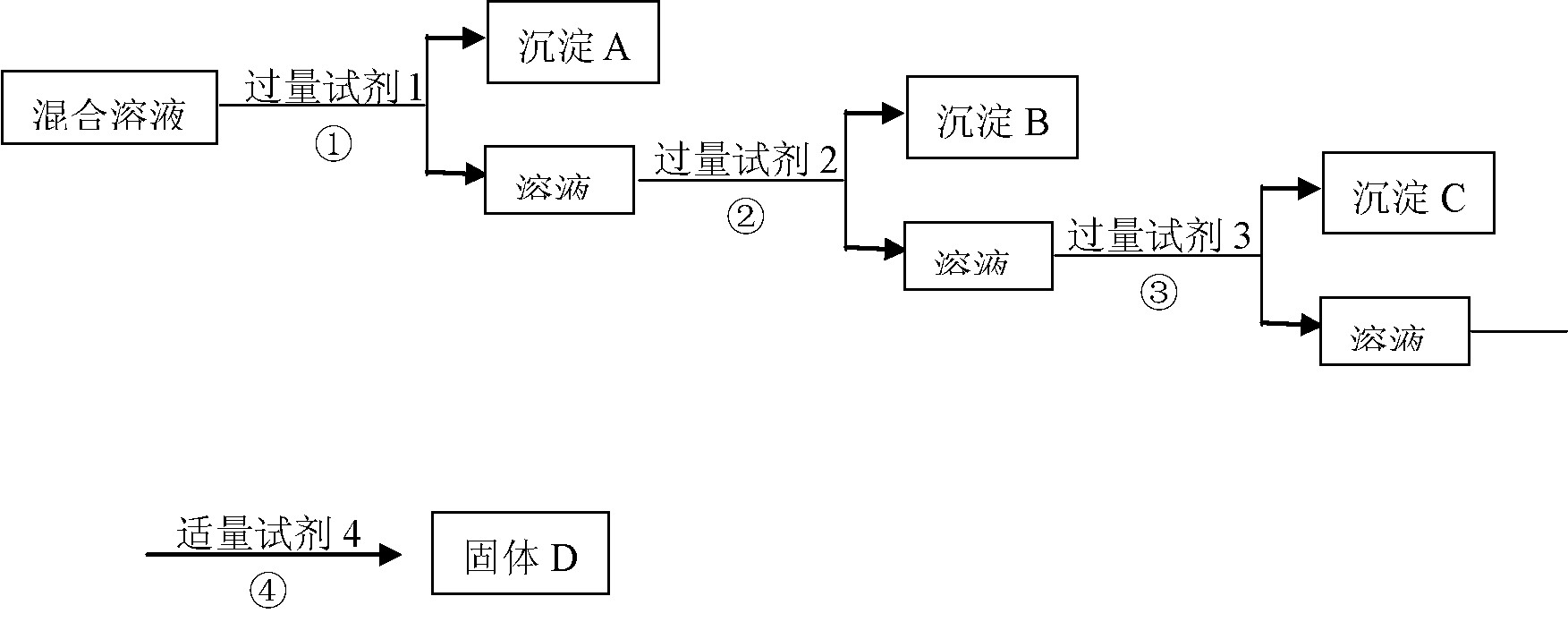
(1) 写出上述实验过程中所用试剂的名称:
试剂1___________试剂2_____________试剂4________________
(2)恰当地控制试剂4的加入量的方法是_________________________________
(3)加入过量试剂3的目的是_______________________________
(4)在加入试剂4后,获得固体D的实验操作④是___________(填操作名称)
查看答案和解析>>
科目: 来源: 题型:
某工业铁红中混有一种黑色的铁的氧化物杂质,为了解杂质的成分及测定铁红的纯度,化学兴趣小组的同学进行了实验探究。请你参与过程分析与交流。
[查阅资料]
①铁的常见氧化物
氧化亚铁(FeO)黑色固体,ω(Fe)=77.8%; 氧化铁(Fe2O3)红色固体,俗称铁红,
ω(Fe)=70.0%;四氧化三铁(Fe3O4)黑色固体,俗称磁性氧化铁,ω(Fe)=72.4%。
②草酸(乙二酸H2CO4)在浓H2SO4存在下受热分解的化学方程式为:
![]()
[实验准备]
①实验的装置图如下

a、草酸 b、工业铁红 c、NaOH溶液 d、澄清石灰水 e、浓H2SO4 f、盐酸
[实验及数据]
取不同质量的样品进行实验,所得实验数据如下:

讨论与分析]
(1)兴趣小组的同学拟以纯净的CO还原铁的氧化物,所设计的实验装置中D、E、F应分别盛放的试剂为 、 、 、(填写序号,下同),其作用依次是
。
上述装置还有不完善之处,你建议改进措施是
(2)由实验数据不难得出,有—组实验数据不可靠,该组数据是 (填序号),该工业粗铁红所含杂质的化学式为 。
(3)该工业铁红中ω(Fe2O3)= 。
查看答案和解析>>
科目: 来源: 题型:
)检查装置气密性是化学实验中的重要操作之一。试按要求回答下列问题:
(1)下列仪器或装置在使用前一定要检查气密性的是____(填序号,下同)。
A、容量瓶 B、洗气瓶 C、分液漏斗 D、酸(碱)式滴定管
(2)下列关于不进行气密性检查可能导致后果的叙述中,正确的是____。
A、收集不到气体 B、造成环境污染
C、观察到的实验现象有误 D、引发爆炸事故 ·
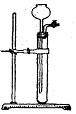
(3)为检查右图所示简易气体发生装置的气密性,甲、乙两位同学进行了以
下操作和方案设计。
①甲同学认为,只要往漏斗中加水,便可检验其气密性是否良好。经检验他
的方案可行。则甲同学的操作方法、现象和结论是 。
②乙同学设计的方案是:往漏斗中注人一定量的水至浸没长颈漏头下端。
关闭活塞,用手捂住试管中上部,待漏斗中液面上升一定高度,打开活塞让液面回落后,迅速关闭活塞,松开手,见漏斗中液面低于试管中液面且不再升降,说明气密性良好。乙同学设计方案的原理是 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
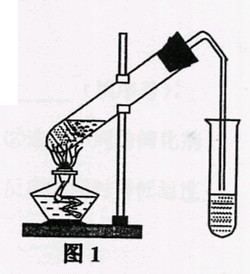
乙酸乙酯是重要的工业原料和溶剂,通常混有少许乙醇和乙酸。
某学习小组利用图1装置制取乙酸乙酯粗产品,再分析乙酸乙酯
的含量。
乙酸乙酯 | 乙醇 | 乙酸 | |
沸点 | 77.1℃ | 78.5℃ | 117.9℃ |
操作步骤如下:
(I)准确称量20.0g乙酸乙酯粗品于锥形瓶中,用0.50mol·L—1NaOH滴定(酚酞做指示剂)。终点时消耗NaOH溶液的体积为40.0mL
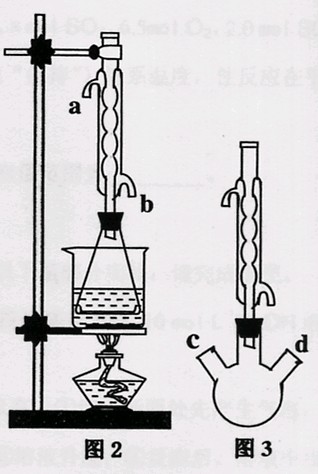
(II)另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL 2.1mol·L—1NaOH溶液混合均匀后,装上冷凝箱,在水浴上加热回流约1小时,装置如图2所示。待冷却后,用0.50mol·L—1HCl滴定过量的NaOH。终点时消耗盐酸的体积为20.0mL。
回答下列问题:
(1)实验(II)中冷水从冷水凝管的 (填a或b)管口通入。
(2)利用实验(I)、(II)测量的数据计算粗产物中乙酸
乙酯的质量分数为 。
(3)实验结束后,同学们对粗产品中乙酸乙酯的含量不高进行讨论。
①有人认为是实验(II)带来的误差。建议将图2中的锥形瓶改为
三颈瓶,装置如图3,在三颈瓶的c、d口装配相关的仪器并进行
恰当的操作,可以提高测定的精确度。你认为在三颈瓶的c、d口
装配相关的仪器或操作是: (填字母);
A.装上温度计,严格控制反应温度
B.实验中经常打开瓶口,用玻璃进行搅拌
C.在反应后期,用事先安装的分液漏斗添加一定量的NaOH溶液
②还有同学认为改进乙酸乙酯的制取装置(图1)才能提高产率。拟出你的一条改进建议 。
查看答案和解析>>
科目: 来源: 题型:
)硫代硫酸钠(Na2S2O3 ·5H2O)俗名大苏打、海波,常用于除卤剂和定影剂。Na2S2O3在酸性条件下极不稳定:S2O![]() +2H+=H2O+SO2↑+S↓。以Na2S、Na2SO3和浓盐酸为原料。在60℃—80℃用新制的S与Na2SO3?反应可制取Na2?S2O3;实验装置如下图。(已知H2SO3酸性比H2S强)
+2H+=H2O+SO2↑+S↓。以Na2S、Na2SO3和浓盐酸为原料。在60℃—80℃用新制的S与Na2SO3?反应可制取Na2?S2O3;实验装置如下图。(已知H2SO3酸性比H2S强)

回答下列问题:
(1)写出试剂的名称:X ;装置B,D的作用是:
B ,D 。
(2)实验开始时,为使反应有效地进行,下列实验操作的顺序是: (填编号)
①打开A中分液漏斗的活塞,向烧瓶中加入液体;②点燃装置A的酒精灯加热;
③点燃装置C的酒精灯加热,。
(3)反应开始后,装置C锥形瓶中的溶液先变浑浊,出现浑浊现象的原因是: 、
(用化学方程式表示);当溶液变澄清时,停止反应;然后将所得混合液趁热过滤,经加热蒸发、冷却得到硫代硫酸钠晶体。
(4)实验时,也可先在装置C的锥形瓶中加入一定量的X和Y的混合物,然后按第(2)第(3)步制取Na2S2O3。要使原子利用率达到100%,则X+Y的物质的量之比是:
。
查看答案和解析>>
科目: 来源: 题型:
李同学在探究铁生锈的条件时,将铁钉浸没在试管里的食盐水中,一段时间后,发现试管底部出现了黑色粉末。李同学对此黑色粉末的组成做了如下几种猜测:①Fe ②Fe2O3 ③Fe3O4 ④FeCl3 ⑤数种物质的混合物。请回答下列问题:
(1)铁钉生锈属于 腐蚀,其正极发生的电极反应为
(2)你认为李同学的上述猜想中,不做实验就可排除的是 (填序号),理由是 ;
你认为黑色粉末还可能是 ,理由是 。
(3)李同学将黑色粉末干燥后,用磁铁靠近,发现粉末能被磁铁吸引,于是得出结论:黑色粉末一定是铁粉。你认为李同学的结论对吗? ,理由是 。如果你认为李同学正确,则不需填写以下内容,如果你认为不对,则请提出可行方案帮助李同学确定黑色粉末的成份。
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组参考工业制硝酸的化学原理,在实验室用下列各装置进行组合来制备硝酸并验证硝酸的性质(所给装置必须用到并且只能用一次,各装置中的试剂均足量。已知常温下CaCl2能吸收氨气)。
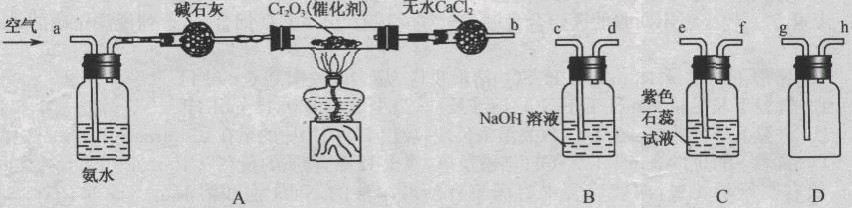
(1)装置的连接顺序为(用a、b、c、d等字母表示):b接( ),( )接( ),( )接( )。
(2)写出氨气催化氧化的化学方程式______________________。
(3)进行实验时,装置A中碱石灰的作用是_____________;D中的现象是____________________。
(4)能证明有硝酸生成的现象是__________________________________________。
(5)实验开始时,下列操作顺序最合理的是______________。
a.先加热A装置中的催化剂.再由导管a通入空气
b.先由导管a通人空气,再加热A装置中的催化剂
c.在由导管a通人空气的同时,加热A装置中的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com