
科目: 来源: 题型:
常温下,AgCl、AgBr、AgI的溶度积(Ksp)依次为1.8×10![]() 、5.0×10
、5.0×10![]() 、8.3×10
、8.3×10![]() 。下列有关说法错误的是 ( )
。下列有关说法错误的是 ( )
A.常温下在水中溶解能力AgCl>AgBr>Agl
B.在AgCl饱和液中加入足量浓NaBr溶液有AgBr沉淀生成
C.在AgBr饱和溶液中加入足量浓NaCl溶液不可能有AgCI沉淀生成
D.在AgI饱和液中加入NaI固体有AgI沉淀析出
查看答案和解析>>
科目: 来源: 题型:
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行: Cd(OH)![]() +2Ni(0H)
+2Ni(0H)![]()
![]() Cd+2NiOOH+2H
Cd+2NiOOH+2H![]() O。由此可知,该电池充电时在阴极 上发生反应的是 ( )
O。由此可知,该电池充电时在阴极 上发生反应的是 ( )
A.Cd(OH)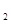 B.Ni(OH)
B.Ni(OH)![]() C.Cd D.NiOOH
C.Cd D.NiOOH
查看答案和解析>>
科目: 来源: 题型:
下图是电解NaCl溶液(加有酚酞)装置,其中c、d为石墨电极。下列有关的判断正确的是( )
A a为负极、d为阳极
B.c电极上的电极反应式为:2H![]() +2e
+2e![]() =2H
=2H![]() ↑
↑
C.电解过程中,d电极附近溶液变红
D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目: 来源: 题型:
(6分)A、B两种物质都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合,要求A,溶液中的水的电离程度小于A 溶液中水的电离程度;B
溶液中水的电离程度;B![]() 溶液中的水的电离程度小于啦溶液中水的电离程度:
溶液中的水的电离程度小于啦溶液中水的电离程度:
(1)请写出下列各物质的化学式:
A![]() ,A
,A![]() ,B
,B![]() ,B
,B![]() 。
。
(2)B![]() 溶液中的水的电离程度小于B
溶液中的水的电离程度小于B![]() 溶液中水的电离程度,其原因是:
溶液中水的电离程度,其原因是:
。
查看答案和解析>>
科目: 来源: 题型:
(5分)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl![]() 溶液、Fe
溶液、Fe![]() (SO
(SO![]() )
)![]() 溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? (填“能”或“不能”)。若能,请写出电极反应式:负极 ,正极 。若不能,请说明原因 。
溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? (填“能”或“不能”)。若能,请写出电极反应式:负极 ,正极 。若不能,请说明原因 。
查看答案和解析>>
科目: 来源: 题型:
(8分)用:NaCl做原料可以得到多种产品。
(1)工业上由NaCI制备金属钠的化学方程式是 。
(2)实验室用惰性电极电解100mL 0.1mol/LNaCl溶液。写出阳极的电极反应方程式:
。
(3)某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液。为使Cl![]() 被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极'b为阳极;HClO和NaCl
假设最后所得溶液中仅含一种溶质,则整个过程用一个化学方程式表示为:
。
查看答案和解析>>
科目: 来源: 题型:
(10分)常温下,向100mL0.01mol·L![]() HA溶液中逐滴加入0.02mol
HA溶液中逐滴加入0.02mol![]() MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计)。回答下列问题:
MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计)。回答下列问题:
(1)由图中信息可知HA为 酸(填“强”或 “弱”),理由是 。
(2)常温下一定浓度的MA稀溶液的pH=![]() ,则
,则![]() 7(填“>”、“<”或“=”),用离子方程式表示其原因为 ,此时,溶液中由水电离出的c(OH
7(填“>”、“<”或“=”),用离子方程式表示其原因为 ,此时,溶液中由水电离出的c(OH![]() )= 。
)= 。
(3)请写出K点所对应的溶液中离子浓度的大小关系: 。
(4)K点对应的溶液中,c(M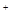 )+c(MOH) 2c(A
)+c(MOH) 2c(A![]() )(填“>”、“<”或“=”);若此时溶液中,pH=lO,则c(MOH)+c(OH
)(填“>”、“<”或“=”);若此时溶液中,pH=lO,则c(MOH)+c(OH![]() )= mol·L
)= mol·L![]() 。(用代数式表示)
。(用代数式表示)
查看答案和解析>>
科目: 来源: 题型:
(7分)火箭推进器中盛有强还原剂液态胼(N![]() H
H![]() 凰)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 KJ的热量。
凰)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 KJ的热量。
(1)反应的热化学方程式为 。
(2)又已知H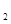 0(I)=H
0(I)=H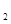 0(g);△H=+44 kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 KJ。
0(g);△H=+44 kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 KJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)已知N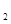 (g)+2O
(g)+2O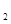 (g)=2N0
(g)=2N0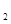 (g) △H=+67.7kJ/mol
(g) △H=+67.7kJ/mol
N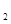 H
H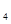 (g)+0
(g)+0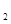 (g)=N
(g)=N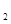 (g)+2H
(g)+2H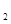 0(g) △H=-534kJ/mol
0(g) △H=-534kJ/mol
则肼与N0![]() 完全反应生成氮气和液态水的热化学方程式为
完全反应生成氮气和液态水的热化学方程式为
查看答案和解析>>
科目: 来源: 题型:
(16分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和
溶解平衡等四种,且均符合勒夏特列原理。请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g) 4C(g) △H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
=4mol/L。试确定B的起始浓度c(B)的取值范围是 ;若改变
条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是 。
①增加C的物质的量②加压 ③升温④使用催化剂
(2)反应C(s)+CO![]() (g)
(g) 2CO(g)平衡常数K的表达式为 ;
已知C(s)+H![]() 0(g)t
0(g)tCO(g)+H
 (g)的平衡常数为K1;H
(g)的平衡常数为K1;H![]() (g)+CO
(g)+CO![]() (g)
(g) C0(g)
+H![]() 0(g)的平衡常数为恐,则K
0(g)的平衡常数为恐,则K 与K
与K![]() 、K
、K![]() 二者的关系为 。
二者的关系为 。
(3)已知某温度下,反应2SO![]() +0
+0![]()
2S0
 的平衡常数K=19。在该温度下的体积
的平衡常数K=19。在该温度下的体积
固定的密闭容器中,co(SO![]() )=lmol·L
)=lmol·L![]() c0(O
c0(O![]() )=1mol·L
)=1mol·L![]() ,当反应在该温度下SO
,当反应在该温度下SO![]() 转化率
转化率
为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向
(填“正反应”或“逆反应”)方向进行。
(4)对于可逆反应:aA(g)+bB(g) cC(g)+riD(g)△H=
![]() kJ·mol
kJ·mol![]() ;若
;若![]() +b>
+b>
c+d,增大压强平衡向 (填“正反应”或“逆反应”)方向移动;若升高温度,平衡向
逆反应方向移动,则![]() 0(填“>”或“<”)。
0(填“>”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com