
科目: 来源:2012-2013学年福建省福州八县(市)一中高二(上)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年福建省福州八县(市)一中高二(上)期末化学试卷(解析版) 题型:解答题

查看答案和解析>>
科目: 来源:2012-2013学年福建省福州八县(市)一中高二(上)期末化学试卷(解析版) 题型:解答题
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2?6H2O呈红色,常温下稳定.110°C~120°C时脱水变成蓝色无水氯化钴 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.0×10-35 | x |
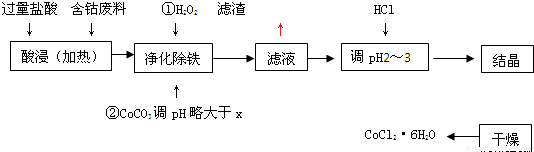
查看答案和解析>>
科目: 来源:2012-2013学年福建省福州八县(市)一中高二(上)期末化学试卷(解析版) 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.04 |
| 2 | 25.00 | 1.50 | 24.50 |
| 3 | 25.00 | 0.20 | 20.21 |
查看答案和解析>>
科目: 来源:2012-2013学年福建省福州八县(市)一中高二(上)期末化学试卷(解析版) 题型:解答题
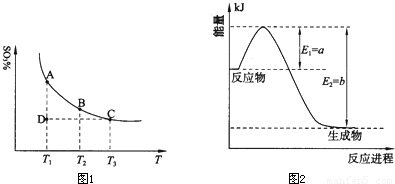
查看答案和解析>>
科目: 来源:2008-2009学年北京101中高一(下)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2008-2009学年北京101中高一(下)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com