相关习题
0 63151 63159 63165 63169 63175 63177 63181 63187 63189 63195 63201 63205 63207 63211 63217 63219 63225 63229 63231 63235 63237 63241 63243 63245 63246 63247 63249 63250 63251 63253 63255 63259 63261 63265 63267 63271 63277 63279 63285 63289 63291 63295 63301 63307 63309 63315 63319 63321 63327 63331 63337 63345 203614
科目:
来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版)
题型:选择题
一定温度下,在固定体积的密闭容器中发生反应:2SO2(g)+O2(g)═2SO3(g).若c(SO3)由0增加到0.06mol?L-1时,需要15s,那么c(SO3) 由0.06mol?L-1增加到0.10mol?L-1时,所需反应时间为( )
A.大于10 s
B.等于10 s
C.小于10 s
D.等于5s
查看答案和解析>>
科目:
来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版)
题型:选择题
X、Y、Z、M是4种短周期元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期.X原子最外层电子数是其电子层数的3倍.Z原子的核外电子数比X原子少1.M是同周期中原子半径最大的元素(除稀有气体元素).下列说法正确的是( )
A.Y元素最高价氧化物对应水化物的化学式可表示为HYO3
B.Z和M组成的化合物为离子化合物,它与盐酸反应可以生成两种盐
C.X、Y、Z元素的气态氢化物中,Y的沸点最高
D.四种元素简单离子的半径由大到小依次为Y>M>X>Z
查看答案和解析>>
科目:
来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版)
题型:选择题
将等质量且过量的两份锌粉a、b中分别加入相同体积、相同物质的量浓度的稀硫酸,同时向a中加入少量硫酸铜溶液,下列各图产生H
2的体积V(L)与时间t(min)的关系中正确的是( )
A.
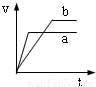
B.
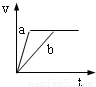
C.
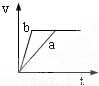
D.
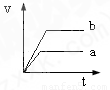
查看答案和解析>>
科目:
来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版)
题型:选择题
在周期表主族元素中,甲元素与乙、丙、丁三元素紧密相邻.甲、丁的原子序数之和等于丙的原子序数;这四种元素原子的价电子数之和为20,下列判断中正确的是( )
A.原子半径:丙>丁>甲>乙
B.甲、乙、丙三种元素位于周期表的同一周期
C.最高价氧化物对应水化物的酸性:乙>甲
D.气态氢化物的稳定性:甲>丙
查看答案和解析>>
科目:
来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版)
题型:选择题
下列实验操作能达到实验目的是( )
| 编号 | 实验目的 | 实验操作 |
| A | 测定溶液的pH值 | 用广泛pH试纸测得溶液的pH为2.3 |
| B | 证明氯化铁与碘化钾溶液发生氧化还原反应 | 将两根用导线相连的铁棒分别插入用盐桥相连的氯化铁、碘化钾溶液中 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
| D | 准确测定体积25mL浓度约为0.15mol?L-1 HCl溶液的浓度 | 用25.00mL碱式滴定管和0.1000mol?L-1 NaOH溶液滴定 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:
来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版)
题型:选择题
下列各组离子,在指定的环境中能大量共存的是( )
A.在酸性溶液中:Na+、K+、MnO4-、S2O32-
B.在中性溶液中:Al3+、K+、SO42-、HCO3-
C.25℃,pH=0的溶液中:Al3+、NH4+、NO3-、Fe2+
D.c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、NO3-
查看答案和解析>>
科目:
来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版)
题型:选择题
在一定条件下,反应xA+yB═zC△H达到平衡状态,下列说法不正确的是( )
A.若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x+y>z
B.若C是气体,且x+y=z,增大压强时,平衡发生移动,则平衡向正反应方向移动
C.若B、C是气体,其他条件不变,增大A的量,平衡不移动,则A不是气态物质
D.若加热后C的质量分数减少,则该反应的焓变△H>0
查看答案和解析>>
科目:
来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版)
题型:选择题
工业制硝酸的其中一步反应为氨的氧化,反应方程式为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ/mol
氧化过程中还伴随有N2O、N2等物质生成.有关该反应的说法正确的是( )
A.反应处于平衡状态时,c(NH3)?c(O2)=c(NO)?c(H2O)
B.反应达到平衡后,3ν正(NH3)=2ν逆(H2O)
C.其它条件不变,温度越高,氨的转化率越高
D.寻找合适的催化剂是加快反应速率并提高NO产率的有效措施
查看答案和解析>>
科目:
来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版)
题型:选择题
银锌纽扣电池由锌粉作负极、氧化银作正极和氢氧化钾溶液构成.电池工作时的反应原理为:Zn+Ag2O+H2O═Zn(OH)2+2Ag.则下列说法正确的是( )
A.电池工作时,负极附近溶液的pH减小
B.电池工作时,溶液中OH-向正极移动
C.电池工作一段时间后,溶液的pH不变
D.电池工作过程中,Ag2O发生还原反应
查看答案和解析>>
科目:
来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版)
题型:选择题
在某密闭容器中投入X、Y进行如下反应:X(g)+2Y(g)

2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足( )
A.1<
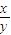
<3
B.

<
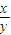
<

C.3<
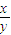
<4
D.

<
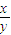
<

查看答案和解析>>






 2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足( )
2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足( )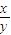 <3
<3 <
<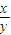 <
<
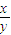 <4
<4 <
<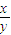 <
<