

科目: 来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版) 题型:解答题
| 温度(℃) | 10 | 20 | 30 | 50 | 70 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |

查看答案和解析>>
科目: 来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版) 题型:解答题
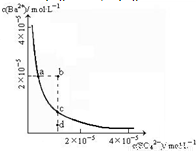
查看答案和解析>>
科目: 来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版) 题型:解答题
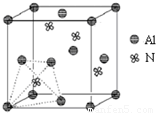
查看答案和解析>>
科目: 来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版) 题型:解答题
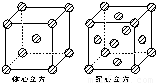
查看答案和解析>>
科目: 来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版) 题型:解答题
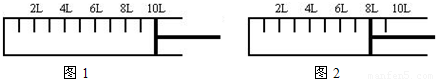
查看答案和解析>>
科目: 来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版) 题型:解答题
| 容器编号 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ______ | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正______ν逆 |
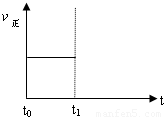
查看答案和解析>>
科目: 来源:2008-2009学年江苏省泰州市高二(下)期末化学试卷(解析版) 题型:解答题
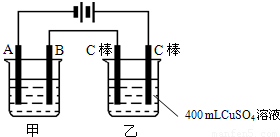
查看答案和解析>>
科目: 来源:2010-2011学年山东省兖州市高二(上)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com