
科目: 来源:2010-2011学年广东省高三上学期第四次测试理综化学部分 题型:选择题
反应2SO2 + O2  2SO3在一定温度下达到平衡,下列说法正确的是
2SO3在一定温度下达到平衡,下列说法正确的是
A、增大压强,平衡向右移动,平衡常数K增大
B、增加O2的浓度平衡向右移动,SO2的转化率增大
C、此时一定满足c(SO2) = 2c(O2)
D、平衡向右移动时反应物的浓度减少,生成物的浓度增加
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三上学期第四次测试理综化学部分 题型:选择题
在0.1mol·L-1 CH3COOH溶液中存在如下电离平衡
CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
A、溶液PH等于1
B、加入少量NaOH固体,平衡向正反应方向移动
C、加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)降低
D、加入少量CH3COONa固体,平衡向左移动,导电能力不变
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三上学期第四次测试理综化学部分 题型:选择题
关于电解NaCl水溶液,下列叙述正确的是
A、将阳极产生的气体通入淀粉KI溶液,溶液变蓝色
B、阴极发生氧化反应,阳极发生还原反应
C、阴极发生还原反应,得到金属钠
D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三上学期第四次测试理综化学部分 题型:选择题
下列实验操作与安全事故处理错误的是
A.使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中
B.萃取分液后,上层溶液从上口倒出,下层溶液从下口放出
C.制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
D.滴定管使用之前首先要检查是否漏水,洗涤之后还要用相应的溶液润洗才能用来滴定
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三上学期第四次测试理综化学部分 题型:选择题
下列说法中正确的是
A.所有原子或其离子的核外电子层数都等于该元素所在的周期数
B.HCI 的酸性比H2S的酸性强,所以CI的非金属性比S的非金属性强
C.O的非金属性比S强,所以H2O 比H2S稳定
D.所有主族元素,同主族从上到下元素的金属性逐渐增强
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三上学期第四次测试理综化学部分 题型:选择题
茉莉醛具有浓郁的茉莉花香,其结构简式如下所示
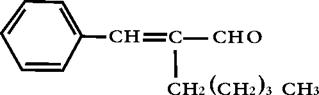
关于茉莉醛的下列叙述错误的是
A.在加热和催化剂作用下,能被氢气还原 B.能使高锰酸钾酸性溶液褪色
C.该茉莉醛是一种芳香烃 D.能与氢溴酸发生加成反应
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三上学期第四次测试理综化学部分 题型:填空题
某芳香烃A有如下转化关系: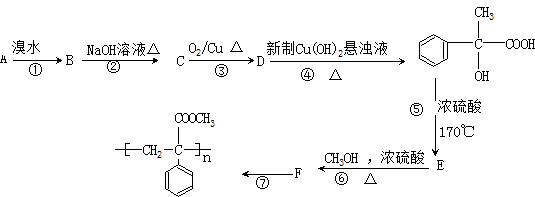
回答下列问题:
(1)写出反应类型:① ,⑥
(2)写出结构简式:A ,F
(3)下列有关F的描述正确的是( )
A、属于芳香烃类化合物 B、能发生取代反应
C、能使溴水和KMnO4溶液褪色 D、能发生加聚反应
(4)写出反应的化学方程式:⑦
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三上学期第四次测试理综化学部分 题型:填空题
在某个容积为2 L的密闭容器内,在T1℃时按下图1所示发生反应:
mA(g)+nB(g)  pD(g)+qE(s),DH<0(m、n、p、q为最简比例的整数)。
pD(g)+qE(s),DH<0(m、n、p、q为最简比例的整数)。
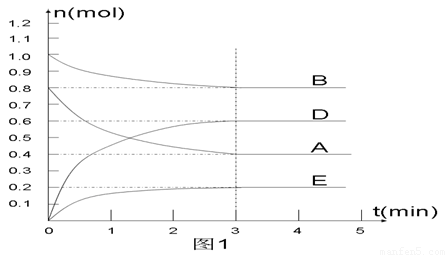
(1)据图1所示,反应开始至达到平衡时,用D表示该反应速率为_____________;
(2)该反应的化学平衡常数K的表达式为________________________________;
(3) 下列措施能增大B的转化率的是 ( )
A.升高温度
B.保持体积不变通入1molB
C.保持体积不变移出部分物质D(g)
D.将容器的容积增大为原来2倍
E. 保持体积不变通入1mol A
(4) 反应开始时向容器中通入一定量的A和B,反应达到平衡时,测得D的浓度为0.6 mol.L-1 。(图2中纵坐标为D的浓度)
①请用实线在下图坐标系中该表示平衡的建立过程。
②若该反应在T2℃(T2> T1)温度下进行,请用虚线画出该平衡的建立过程。
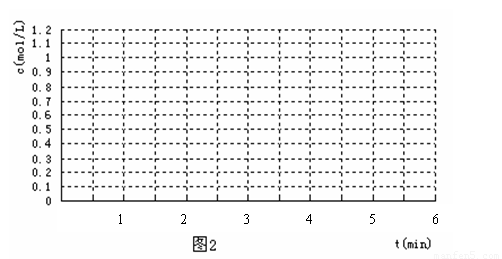
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三上学期第四次测试理综化学部分 题型:填空题
孔雀石主要含Cu2(OH)2CO3,还含少量杂质FeO、Fe2O3、SiO2。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:

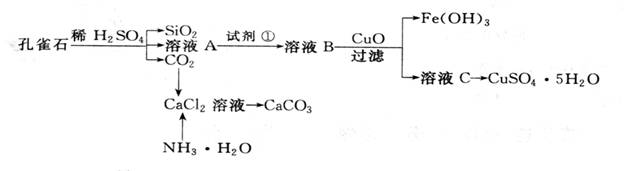
 请回答下列问题:
请回答下列问题:
(1)溶液A的金属离子有__________。检验溶液A中Fe3+的最佳试剂为
 A、KMnO4 B、(NH4) 2S
C、H2O2
D、KSCN
A、KMnO4 B、(NH4) 2S
C、H2O2
D、KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。
 (3)制备CaCO3时,应向CaCl2溶液中先加入NH3.H2O,然后通入CO2,反应的方程式:__________________________________________________________________。
(3)制备CaCO3时,应向CaCl2溶液中先加入NH3.H2O,然后通入CO2,反应的方程式:__________________________________________________________________。

 (4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
(5)探究氧化铜的性质:取A、B两支试管,往A中加入适量的CuO粉末,再分别向A和B加入等体积3% H2O2溶液,只观察到A中有大量气泡,结论是: 。
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三上学期第四次测试理综化学部分 题型:实验题
利用铝热反应焊接钢轨的原理是2Al+Fe2O3 2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
样品处理:将褐色硬块处理成粉末状。
(1)研究小组首先取少量粉末加入 溶液中,发现粉末部分溶解,但没有气泡产生,实验结论是:粉末中含有Al2O3而没有Al。
(2)根据以述实验判断该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3。
提出假设:
假设1:固体粉末中除Al2O3外还有Fe;
假设2:固体粉末中除Al2O3外还有 ;
假设3:固体粉末中除Al2O3外还有Fe和Fe2O3。
实验实施:
(3)请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3mol/LNaOH、3mol/LHCl、3mol/LHNO3、3mol/LCuSO4、0.01mol/LKMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。
|
实验操作 |
预期现象和结论 |
|
|
|
|
步骤2:将步骤1的滤渣转移到烧杯B中,加入足量 ,充分搅拌,过滤,洗涤。 |
有红色固体生成,说明粉末中含有
。 |
|
步骤3:将步骤2的滤渣转移到烧杯C中,
。 |
, 说明粉末中含有Fe2O3。(1分) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com