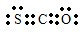二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染.
(1)可利用甲烷催化还原NOx的方法处理NO
x,反应如下:
CH
4(g)+4NO
2(g)=4NO(g)+CO
2(g)+2H
2O(g);△H=-574kJ?mol
-1CH
4(g)+4NO(g)=2N
2(g)+CO
2(g)+2H
2O(g);△H=-1160kJ?mol
-1则CH
4(g)+2NO
2(g)=N
2(g)+CO
2(g)+2H
2O(g);△H=______;
(2)汽车尾气中的主要污染物有CO、NOx、碳氢化合物等,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)?N
2(g)+2CO
2(g);△H<0.
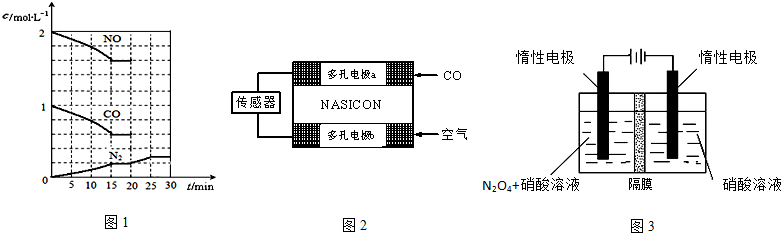
生成无毒物质,减少汽车尾气污染.若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图1所示,则
①前15s内的平均反应速率v (N
2)=______(小数点保留3位);
②该反应平衡常数K=______(小数点保留3位);
③若保持温度不变,20min时再向容器中充入CO、N
2各0.6mol,平衡将______移动(填“向左”、“向右”或“不”);20min时,若改变反应条件,导致N
2浓度发生如图1所示的变化,则改变的条件可能是______(填序号);
a 加入催化剂 b 降低温度 c 缩小容器体积 d 增加CO
2的量
④该可逆反应△S______0(填“>”、“<”或“=”),在______(填“高温”、“低温”或“任何温度”)下能自发进行.
(3)CO分析仪以燃料电池为工作原理,其装置如图2所示,该电池中电解质为氧化钇-氧化钠,其中O
2-可以在固体介质NASICON中自由移动.下列说法错误的是______
A.负极的电极反应式为:CO+O
2--2e
-=CO
2B.工作时电极b作正极,O
2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
(4)利用Fe
2+、Fe
3+的催化作用,常温下将SO
2转化为SO
42- 而实现对SO
2的处理目的.其中Fe
3+的最外层电子排布式为______;SO
2的VSEPR模型名称为______;与SO
2互为等电子体的离子有______.
(5)N
2O
5是重要的硝化剂和氧化剂,可用电解法制备N
2O
5,如图3所示,N
2O
5在电解池的______(填“阳极”或“阴极”)区生成,其电极反应式为______.