
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
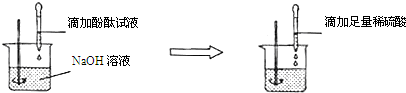
查看答案和解析>>
科目: 来源: 题型:
 26、框图中A是人体胃液中含有的物质,B可用于改良酸性土壤,J是最常见的金属,G是红棕色粉末,E、F、I为无色气体,I能使湿润的红色石蕊试纸变蓝.
26、框图中A是人体胃液中含有的物质,B可用于改良酸性土壤,J是最常见的金属,G是红棕色粉末,E、F、I为无色气体,I能使湿润的红色石蕊试纸变蓝.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com