
科目: 来源:济南一模 题型:单选题
| A.碳酸氢铵溶液和足量的氢氧化钠溶液混合的离子反应:HCO3-+OH-=CO32-+H2O |
| B.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
| C.等物质的量浓度的NH4Cl溶液和NH3?H2O溶液,溶液中c(NH4+)前者小于后者 |
| D.25℃时,pH=8的0.1mol?L-1 NaX溶液中由水电离出的c (OH-)=1×10-8mol?L-1 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:台州模拟 题型:问答题
| 烧杯号 | V氨水 (mL) | V水(mL) | c (NH3?H2O) (mol?L-1) | c(OH-) | Kb | α |
| 1 | 50.00 | 0.00 | 1.34×10-3 | |||
| 2 | 25.00 | 25.00 | 9.48×10-4 | |||
| 3 | 5.00 | 45.00 | 4.24×10-4 |
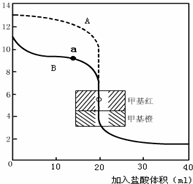
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.将1mL1.0×10-5mol/L盐酸稀释到1000mL,得到pH=8的盐酸 |
| B.将1mLpH=3的一元酸溶液稀释到10mL,若溶液的pH<4,则此酸为弱酸 |
| C.用pH=1的盐酸分别中和1mLpH=13NaOH溶液和氨水,NaOH消耗盐酸的体积大 |
| D.pH=2的盐酸与pH=1的硫酸比较,c(Cl-)=c(SO42-) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 硫酸 |
| pH | 11 | 11 | 3 | 3 |
| A.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 |
| B.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11 |
| C.分别加水稀释10倍、四种溶液的pH:①>②>③>④ |
| D.将①、④两种溶液等体积混合,所得溶液中:c(NH+4)>c(SO2-4)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.0.1 mol?L-l的醋酸加水稀释,c(H+)/c(OH-)减小 |
| B.体积相同、pH相同的醋酸和盐酸完全溶解等量的镁粉,后者用时少 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 |
| D.VlL pH=11的NaOH溶液与V2L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 |
| B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 |
| C.向水中加入少量CH3COONa固体,平衡向正反应方向移动,KW增大 |
| D.将水加热,平衡向正反应方向移动,KW不变 |
查看答案和解析>>
科目: 来源:不详 题型:多选题
| A.c(Ac-)>c(Cl-)>c(H+)>c(HAc) |
| B.c (Na+)+c (H+)=c (Ac-)+c (Cl-) |
| C.c (Ac-)=c (Cl-)>c (H+)>c (HAc) |
| D.c (Ac-)>c (Cl-)>c (HAc)>c(H+) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.加人足量的小苏打固体充分反应后,两溶液中产生的CO2一样多 |
| B.加入NaOH固体恰好中和后,两溶液的pH相同 |
| C.分别加入足量锌粉充分反应,反应开始时两酸产生H2的反应速率相等 |
| D.加水稀释100倍后,两溶液的pH相同 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.物质的量浓度相同的盐酸和醋酸溶液中的H+浓度也相同 |
| B.相同浓度的醋酸和醋酸钠溶液混合,得到溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C.pH=2的两溶液稀释100倍后,pH都为4 |
| D.两溶液中都加入钾盐,H+浓度都减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com