
科目: 来源:2016-2017学年安徽省高二上月考一化学试卷(解析版) 题型:填空题
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ/mol表示。请认真观察下图,然后回答问题。
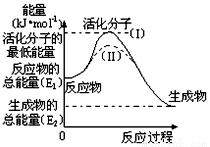
(1)图中反应___________(填“需要”或“不需要”)环境先提供能量,该反应的△H=_________(用含E1、E2的代数式表示)。
(2)对于同一反应,图中虚线(II)与实线(I)相比,活化能________,因此反应速率________,你认为改变的条件是__________。
(3)已知常温下拆开1molH-H键,1molN-H键,lmolN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为:_______________。
查看答案和解析>>
科目: 来源:2016-2017学年安徽省高二上月考一化学试卷(解析版) 题型:填空题
一定温度下,在密闭容器中发生反应:
2SO2(g)+O2(g) 2SO3(g) △H =-196 kJ/mol
2SO3(g) △H =-196 kJ/mol
请填空:(填>、=、<;增大、减小、不变)
(1)当容器体积不变,①向容器中充入1mol SO2和0.5mol O2,②向容器中充入1mol SO3。两种情况下反应分别达到平衡后,放出和吸收的热量分别为Q1和Q2,则Q1+Q2____________98KJ。
①中达到平衡后,再向容器中加入1mol SO2和0.5mol O2,重新达到平衡,O2体积分数___________。
②中达到平衡后分离出部分SO3,重新平衡后,SO3的浓度________。
(2)保持压强不变,①向容器中充入1mol SO2和0.5mol O2,②向容器中充入1mol SO3,反应达到平衡时,SO2和O2的转化率前者________后者;再向容器中充入1mol SO2和0.5mol O2,重新达到平衡后,SO2的浓度________、O2物质的量_________原平衡的2倍。
查看答案和解析>>
科目: 来源:2016-2017学年安徽省高二上月考一化学试卷(解析版) 题型:填空题
2016年9月3日,二十国集团领导人杭州峰会之前,中国政府率先签署了《巴黎协定》并向联合国交存批准文书,体现中国为应对全球气候变化做出了重要贡献。为减少CO2对环境造成影响,有科学家提出设想,先把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇,流程如下:
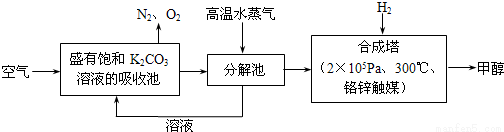
(1)写出分解池中反应的化学方程式___________________。
(2)在合成塔中,当有8.8gCO2与足量H2完全反应,可放出9.84×l03kJ的能量,写出合成塔中反应的热化学方程式______________________。
(3)在体积为l L的密闭容器中,充入1molCO2和3molH2在300℃下发生反应,有关物质的浓度随时间变化如下图所示。
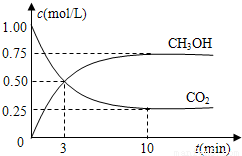
①从反应开始到平衡,H2的平均反应速率v(H2)=_______ _____。
②其他条件不变,只将温度提高到500℃,再次平衡时n(CH3OH)/n(CO2)比值___________(填“增大”、“减小”或“不变”)。
③从平衡移动原理分析,低温有利于提高原料气的转化率,而实际生产中采用300℃的温度,原因是_______________。
(4)目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H>0。
CH3OCH3(g)+3H2O(g) △H>0。
判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是_________。
a.容器中密度不变
b.单位时间内消耗2molCO2,同时消耗1mol二甲醚
c.v(CO2):v(H2)=1:3
d.容器内压强保持不变
查看答案和解析>>
科目: 来源:2016-2017学年安徽省高二上月考一化学试卷(解析版) 题型:填空题
氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式:
口H2PO2-+口Ag++口________=口PO43-+口Ag+口________
(2)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:
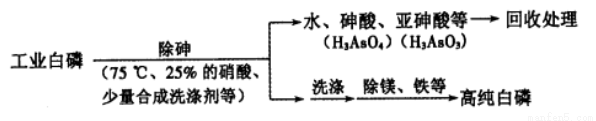
①关于除砷条件的说法合理的是__________(填字母)。
a.75℃使白磷熔化,并溶于水 b.硝酸浓度不易过大,防止白磷反应
c.温度不易过高,防止硝酸分解 d.适当提高温度,加快化学反应速率
②硝酸氧化除砷时被还原为NO,氧化相同质量的砷.当转化为亚砷酸的量越多,消耗硝酸的量越 _____________(填“多”或“少”)。
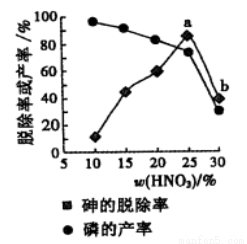
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如右图,砷的脱除率从a点到b点降低的原因是_____________。
(3)某温度下,已知:
Ag+(aq)+2NH3(aq)  Ag(NH3)2+(aq) k1=1.10×107
Ag(NH3)2+(aq) k1=1.10×107
AgCl(s) Ag+(aq)+Cl-(aq) K2=1.45×10-10
Ag+(aq)+Cl-(aq) K2=1.45×10-10
①反应平衡常数的表达式K1=______________。
②计算可逆反应AgCl(s)+2NH3(aq) Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。
③1Llmol/L氨水中最多可以溶解AgCl__________mol(保留1位有效数字,忽略溶液体积变化)。
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上月考一化学试卷(解析版) 题型:选择题
反应A+B→C(△H<0)分两步进行:① A+B→X (△H >0)② X→C(△H<0),下列示意图中,能正确表示总反应过程中能量变化的是( )
A.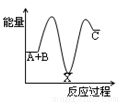 B.
B.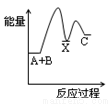 C.
C.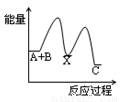 D.
D.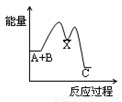
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上月考一化学试卷(解析版) 题型:选择题
有关碰撞理论,下列说法中正确的是 ( )
A.具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应
B.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大
C.升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能,从而只影响反应速率不影响化学平衡
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上月考一化学试卷(解析版) 题型:选择题
恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s) 2C(g)达到平衡的标志的是( )
2C(g)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等
②单位时间生成amol A,同时消耗1.5amol B;
③各组分的浓度不再变化;
④混合气体的密 度不再变化;
度不再变化;
⑤混合气体的总压强不再变化;
⑥混合气体的物质的量不再变化;
⑦混合气体的平均摩尔质量不再变化;
⑧A、B、C的分子数目比为2:3:2.
A.⑤⑥⑧ B.②⑤⑧ C.①③④ D.②④⑦
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上月考一化学试卷(解析版) 题型:选择题
在C(s)+CO2(g) 2CO(g)的反应中,现采取下列措施:①缩小体积,增大压强②增加碳的量 ③通入CO2 ④恒容下充入He ⑤恒压下充入He ⑥加热,其中能够使反应速率增大的措施是( )
2CO(g)的反应中,现采取下列措施:①缩小体积,增大压强②增加碳的量 ③通入CO2 ④恒容下充入He ⑤恒压下充入He ⑥加热,其中能够使反应速率增大的措施是( )
A.①④ B.②③⑤ C.①③⑥ D.①②④
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上月考一化学试卷(解析版) 题型:选择题
在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(气)+xB(气) 2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是( )
2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是( )
A.平衡时,物质的量比A∶B∶C=2∶11∶4
B.x值等于4
C.B的平均反应速率为0.04 mol·L-1·min-1
D.A的转化率20%
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上月考一化学试卷(解析版) 题型:选择题
在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知v(A)、v(B)、v(C)之间有以下关系2v(B)=3v(A),3v(C)=2v(B)。则此反应可表示为( )
A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com