
科目: 来源: 题型:
2010年4月7日,俄罗斯科学家宣布在实验中获得了![]() 和
和![]() 两种新原子。下列有关这两种原子的说法错误的是( )
两种新原子。下列有关这两种原子的说法错误的是( )
A.质量数均超过质子数的两倍 B.互称为同位素
C.中子数分别为176、177 D.是同一种核素
查看答案和解析>>
科目: 来源: 题型:
2009年6月5日是第三十八个世界环境日,该年度世界环境日的主题是:冰川消融,后果堪忧。在近百年间,全球平均气温升高了0.74℃,预计到本世纪末全球气温将升高1.1~6.4℃。下列做法可以减缓全球气温升高的是
①大力进行植树造林;②以煤等燃料为主要生活燃料;③鼓励私人购买和使用小汽车以代替公交车;④利用太阳能、风能和氢能新能源代替化石燃料;⑤禁止电动自行车上路
A.①③④ B.②⑤ C.①④ D.②③⑤
查看答案和解析>>
科目: 来源: 题型:
化合物A(分子式为C9H902Br)在一定条件下有如下的转化关系,其中1molC与Na完全反应生成1 mol H2,若与NaHC03完全反应能产生1 mol CO2,D和E互为同分异构体,但D可以使溴的四氯化碳溶液褪色,而E分子中有一个苯环和一个五元环。
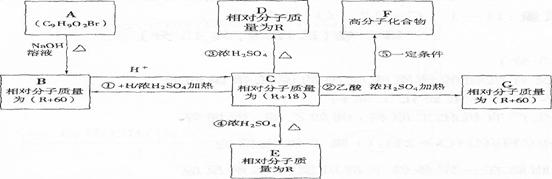
(1)写出A含有官能团的名称: 。
(2)H可能是(写名称): 。
(3)写出反应②、③的反应类型:② 、③ 。
(4)写出E、G的结构简式E 、G 。
(5)反应⑤的化学方程式: 。
(6)同时满足下列条件的C的同分异构体有 种:
①能发生银镜反应;
②l mol该物质可以消耗3 mol NaOH;
③苯环上的一氯代物有3种。
查看答案和解析>>
科目: 来源: 题型:
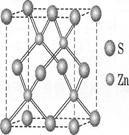
 有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大 的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E20和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如右图所示.请回答下列问题.
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大 的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E20和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如右图所示.请回答下列问题.
(1)E元素原子基态时的电子排布式为 .
(2)A2F分子中F原子的杂化类型是
(3)CA3极易溶于水,其原因主要是 ,
 (4)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途.富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为 ;1 molC60分子中σ键的数目为 .
(4)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途.富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为 ;1 molC60分子中σ键的数目为 .
(5)多元化合物薄膜太阳能电池材料为无机盐,其主要包括
砷化镓、硫化镉、硫化锌及铜铟硒薄膜电池等.
①第一电离能:As Se(填“>”“<”或“=”).
②硫化锌的晶胞中(结构如下图所示),硫离子的配位数
是 与S距离最近且等距离的S之间的距离为
(密度为ρg/cm3)
③二氧化硒分子的空间构型为 .
查看答案和解析>>
科目: 来源: 题型:
随着经济的发展和人民生活水平的提高,近年来我省汽车拥有量呈较快增长趋势。
⑴乙丙橡胶(![]() )因柔韧性好而被用于制造汽车门窗密封胶条,工业生产乙丙橡胶的单体是 。
)因柔韧性好而被用于制造汽车门窗密封胶条,工业生产乙丙橡胶的单体是 。
 ⑵金属防护对汽车工业具有重要意义。铝的阳极氧化是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化铝薄膜,该氧化膜不溶于电解时使用的电解液——稀硫酸。写出该过程阳极反应的电极反应式 。
⑵金属防护对汽车工业具有重要意义。铝的阳极氧化是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化铝薄膜,该氧化膜不溶于电解时使用的电解液——稀硫酸。写出该过程阳极反应的电极反应式 。
 ⑶在发动机和三元催化转化器间的尾气流中安装一个称为λ探测器的电化学元件,可测定λ(λ=入口处的空气量/完全燃烧需要的空气量)值,如右图所示。当汽车速度增加时,入口处的空气量增大,此时排出尾气中的主要污染物是 。在转化器的前半部,一氧化碳和氮氧化物(NOx)通过催化剂发生反应转化为无污染的气体,其反应的化学方程式为 。为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料。已知:甲醇燃烧热为726kJ/mol。请写出甲醇燃烧的热化学方程式 。
⑶在发动机和三元催化转化器间的尾气流中安装一个称为λ探测器的电化学元件,可测定λ(λ=入口处的空气量/完全燃烧需要的空气量)值,如右图所示。当汽车速度增加时,入口处的空气量增大,此时排出尾气中的主要污染物是 。在转化器的前半部,一氧化碳和氮氧化物(NOx)通过催化剂发生反应转化为无污染的气体,其反应的化学方程式为 。为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料。已知:甲醇燃烧热为726kJ/mol。请写出甲醇燃烧的热化学方程式 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
某化学兴趣小组在做《浓度对化学反应速率的影响》实验时发现,草酸溶液与高锰酸钾溶液反应时,溶液褪色先慢后快。为了探究此反应速率由小变大的原因,甲同学做了如下实验。
(1)0.10mol/L H2C2O4溶液的配制:
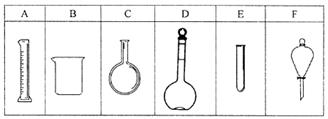
实验室欲配制80mL 0.10mol/L H2C2O4 溶液,需要称取草酸晶体(H2C2O4·2H2O g(精确到0.1g);实验中需要用到的玻璃仪器除了玻璃棒、胶头滴管、量筒外还有: 。(填代号)
(2)反应速率变化的探究
| 1号试管 | 2号试管 | |
| 所加试剂 | 2mL0.10mol/L H2C2O4 溶液, 几滴稀硫酸,4mL0.010mol/L 的KMnO4溶液 | 2mL0.10mol/L H2C2O4 溶液,几 滴稀硫酸,4mL0.010mol/L的 KMnO4溶液,少量MnSO4固体。 |
| 褪色时间 | 31秒 | 4秒 |
①H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为 。
②甲同学能够得出结论 。
(3)在一定条件下,容积为100 L密闭容器中发生反应:CH4(g)+H20(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
 ΔH>0,将1.O molCH4和2.O mol H 20(g)通入该密闭容器,10 min时有O.1 mol CO生成,则10 min内该反应的平均速率ν(H2) 。
ΔH>0,将1.O molCH4和2.O mol H 20(g)通入该密闭容器,10 min时有O.1 mol CO生成,则10 min内该反应的平均速率ν(H2) 。
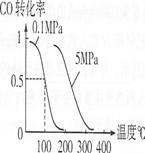
(4)在压强为O.1 MPa条件下,容积为V L某密闭容器中amol CO与2amol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
①该反应的AH O(填“<”、“>”或“=”)。
②100℃时该反应的平衡常数K (用含n、V的代数式表示)。
③在其它条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”),平衡常数 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com