
科目: 来源: 题型:解答题
 CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 某溶液 冒出气泡 冒出气泡 | 说明原溶液中一定含有CO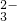 |
| B | SiO2与纯碱高温可生成CO2 | 说明硅酸的酸性比碳酸强 |
| C | 碘化钾溶液久置显黄色 | 是由于I-被还原,析出的I2溶于溶液中 |
| D | 铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应 | 说明铁钉表面形成了一层致密稳定的氧化膜 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 不纯物 | 除杂试剂 | 分离方法 |
| 苯(苯酚) | ________ | ________ |
| 乙醇(水) | ________ | ________ |
查看答案和解析>>
科目: 来源: 题型:解答题
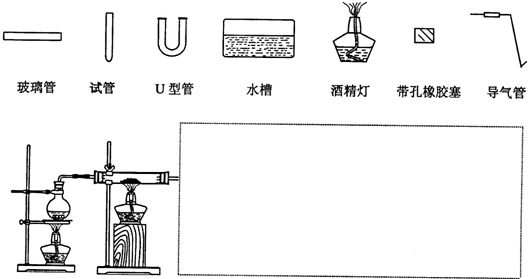
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com