
科目: 来源: 题型:
下列鉴别方法可行的是
A.用氨水鉴别Al3+、Mg2+和Ag+
B.用Ba(NO3)2溶液鉴别Cl-、SO![]() 和CO
和CO![]()
C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷
D.用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO
查看答案和解析>>
科目: 来源: 题型:
下列液体均处于25℃,有关叙述正确的是
A.某物质的溶液pH < 7,则该物质一定是酸或强酸弱碱盐
B.pH = 4.5的番茄汁中c(H+)是pH = 6.5的牛奶中c(H+)的100倍
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.pH = 5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO-)
查看答案和解析>>
科目: 来源: 题型:
下列实验设计及其对应的离子方程式均正确的是
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ =Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2 :Na2O2+ H2O = 2Na++ 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O =2H+ + Cl- + ClO-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO![]() +6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
查看答案和解析>>
科目: 来源: 题型:
下列各表述与示意图一致的是
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g) + O2(g) 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10mL 0.01 mol·L-1KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)![]() CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目: 来源: 题型:
(18分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl,再烘干、焙烧除去水分得到粉体TiO2 。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
⑴ TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________。
⑵ 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
⑶ 下列可用于测定TiO2粒子大小的方法是_____________________(填字母代号)。
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
⑷ 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。
![]()
![]()

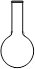

a b c d e
⑸ 滴定终点的现象是___________________________________________________。
⑹ 滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
⑺ 判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果_________________________。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
查看答案和解析>>
科目: 来源: 题型:
(14分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴ 煤的气化的主要化学反应方程式为:_____________________________________。
⑵ 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_________________________________________________________。
⑶ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g) CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) CH3OCH3(g)+ CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应②2CH3OH(g) CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= _________;该时间内反应速率v(CH3OH) = __________。
查看答案和解析>>
科目: 来源: 题型:
以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济的是
A.发展氢能和太阳能
B.限制塑料制品的使用
C.提高原子利用率,发展绿色化学
D.尽量用纯液态有机物代替水作溶剂
查看答案和解析>>
科目: 来源: 题型:
化学已渗透到人类生活的各个方面。下列说法不正确的是
A.阿司匹林具有解热镇痛作用
B.可以用Si3N4、Al2O3制作高温结构陶瓷制品
C.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
D.禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染
查看答案和解析>>
科目: 来源: 题型:
下列鉴别方法可行的是
A.用氨水鉴别Al3+、Mg2+和Ag+
B.用Ba(NO3)2溶液鉴别Cl-、SO![]() 和CO
和CO![]()
C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷
D.用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com