
科目: 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.3.6g碳与3.36LO2一定条件下恰好完全反应,生成CO分子数一定为0.3 NA
B.6.9g钠与足量的CO2和H2O(g)混合气体充分反应,转移的电子数一定为0.3NA
C.25℃时, 0.15mol/L的Na2CO3溶液中,Na+数目为0.3NA
D.标准状况下,2.24L三氯甲烷中含有C-Cl键数目为0.3NA
查看答案和解析>>
科目: 来源: 题型:
某化合物的分子式为C5H11Cl,分析数据表明:分子中有两个-CH3、两个-CH2-、一个![]() 和一个-Cl,它的可能的结构有几种(本题不考虑对映异构体)( )
和一个-Cl,它的可能的结构有几种(本题不考虑对映异构体)( )
A.2 B.3 C.4 D.5
查看答案和解析>>
科目: 来源: 题型:
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 物质编号 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| ① | | Cu | CuO | CuCl2 | Cu(NO3)2 |
| ② | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| ③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 | |
| ④ | Al(OH)3 | Al2O3 | NaAlO2 | AlCl3 |
A.①②③ B.①③④ C.②④ D.①②③④
查看答案和解析>>
科目: 来源: 题型:
下列关于电解质溶液的叙述正确的是( )
A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:
c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ)
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.将pH = 4的盐酸稀释后,溶液中所有离子的浓度均降低
查看答案和解析>>
科目: 来源: 题型:
某些化学键键能数据如下:
则下列热化学方程式不正确( )
A.H2(g)+
Cl2(g)HCl(g);
=-91.5
B.H2(g)+ Cl2(g)2HCl(g);=-183
C.H2(g)+
Cl2(g)HCl(g);
=+91.5
D.2HCl(g)H2(g)+ Cl2(g);= +183
查看答案和解析>>
科目: 来源: 题型:
将1molSO2和1molO2通入容积固定的密闭容器中,在一定条件下反应达到平衡,平衡时SO3物质的量为0.3mol。此时若移走0.5mol SO2和0.5mol O2,则反应达到新平衡时SO3的物质的量是 ( )
A.0.3mol B.0.15mol
C.小于0.15mol D.大于0.15mol且小于0.3mol
查看答案和解析>>
科目: 来源: 题型:阅读理解
(14分)黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS)进行如下实验探究。
[实验一]:测定硫元素的含量
I.将mg该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
问题讨论:
(1)I中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有________________________、________________________________。
(2)Ⅱ中。所加HO溶液需足量的理由是________________。
(3)该黄铁矿石中硫元素的质量分数为________________。
[实验二]:设计以下实验方案测定铁元素的含量
问题讨论:
(4)②中,若选用铁粉作还原剂。你认为合理吗? ________。若不合理,会如何影响测量结果:________(若合理,此空不答)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
(6)④中高锰酸钾溶液应放在_____滴定管中;判断滴定终点的现象为________________。
查看答案和解析>>
科目: 来源: 题型:
(15分)A、B、C、D、E是中学常见的5种化合物,A、B是氧化物。
Ⅰ、元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
(1)X的单质与A反应的化学方程式是_____。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是_____。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是_____。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)_____。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是 。
Ⅱ、若X、Y是非金属单质,试剂3是NaOH溶液,F的水溶液可作木材的防火材料,则X的单质与A反应的化学方程式是__________,试剂1和C的化学式分别是_____、_____。Y在工业上的主要用途是________(写一种)。
查看答案和解析>>
科目: 来源: 题型:
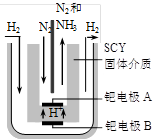
(14分)合成氨对工、农业生产和国防都有重要意义。
已知:N2(g)+3H2(g)![]() 2NH3(g);△H=-92.4 kJ·mol-1,请回答:
2NH3(g);△H=-92.4 kJ·mol-1,请回答:
(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的是_____(填字母)。
a.用铁触媒(催化剂)加快化学反应速率
b.采用较高压强(20 MPa~50 MPa)
c.将原料气中的少量CO等气体净化除去
d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。
①若容器容积V恒定,达到平衡时,气体的压强为原来的![]() ,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
②若容器压强恒定,则达到平衡时,容器中N2的转化率а2__а1(填“>、<或=”)。
(3)随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。钯电极A是电解池的____极(填“阳”或 “阴”),该极上的电极反应式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com