相关习题
0 62281 62289 62295 62299 62305 62307 62311 62317 62319 62325 62331 62335 62337 62341 62347 62349 62355 62359 62361 62365 62367 62371 62373 62375 62376 62377 62379 62380 62381 62383 62385 62389 62391 62395 62397 62401 62407 62409 62415 62419 62421 62425 62431 62437 62439 62445 62449 62451 62457 62461 62467 62475 203614
科目:
来源:2011-2012学年江苏省宿迁市泗洪县洪翔中学高二(下)期中化学试卷(解析版)
题型:选择题
强酸溶液A与强碱溶液B,在常温下其pH之和为15,当它们按一定体积比混合时,溶液的pH恰好为7,则A与B的体积比为( )
A.1:1
B.2:1
C.1:10
D.10:1
查看答案和解析>>
科目:
来源:2011-2012学年江苏省宿迁市泗洪县洪翔中学高二(下)期中化学试卷(解析版)
题型:选择题
下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-)
查看答案和解析>>
科目:
来源:2011-2012学年江苏省宿迁市泗洪县洪翔中学高二(下)期中化学试卷(解析版)
题型:选择题
设NA是阿伏加德罗常数的数值,下列说法正确的是( )
A.1molAl3+离子含有的核外电子数为10NA
B.1molCl2与足量的铁反应,转移的电子数为3NA
C.10LpH=1的硫酸溶液中含有的H+离子数为2NA
D.10LpH=13的NaOH溶液中含有的OH-离子数为NA
查看答案和解析>>
科目:
来源:2011-2012学年江苏省宿迁市泗洪县洪翔中学高二(下)期中化学试卷(解析版)
题型:选择题
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?xC(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强).在图中,Y轴指 ( )
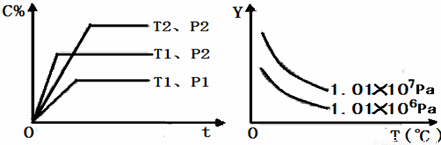
A.平衡混合气中反应物A的百分含量
B.平衡混合气中反应物B的百分含量
C.平衡混合气的密度
D.平衡混合气的平均摩尔质量
查看答案和解析>>
科目:
来源:2011-2012学年江苏省宿迁市泗洪县洪翔中学高二(下)期中化学试卷(解析版)
题型:填空题
氢氧化铜悬浊液中存在如下平衡:Cu(OH)2 (s)?Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)?c2(OH-)=
2×10-20mol2?L-2.
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 .
(2)要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 .
查看答案和解析>>
科目:
来源:2011-2012学年江苏省宿迁市泗洪县洪翔中学高二(下)期中化学试卷(解析版)
题型:填空题
830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,试回答下列问题:
(1)若起始时c(CO)=2mol?L-1,c(H2O)=3mol?L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
(2)在相同温度下,若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,反应进行一段时间后,测得H2的浓度为0.5mol?L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”).
查看答案和解析>>
科目:
来源:2011-2012学年江苏省宿迁市泗洪县洪翔中学高二(下)期中化学试卷(解析版)
题型:填空题
(1)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知:N≡N键的键能是948.9kJ?mol-1,H-H键的键能是436.0kJ?mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量.N-H键的键能是 .
(2)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ?mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式: .
查看答案和解析>>
科目:
来源:2011-2012学年江苏省宿迁市泗洪县洪翔中学高二(下)期中化学试卷(解析版)
题型:解答题
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO
2+4H
++2SO
2-4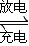
2PbSO
4+2H
2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是______;电解液中H
2SO
4的浓度将变______;当外电路通过1mol电子时,理论上负极板的质量增加______g.
(2)在完全放电耗尽PbO
2和Pb时,若按题右图连接,电解一段时间后,则在A电极上生成______、B电极上生成______,此时铅蓄电池的正负极的极性将______.
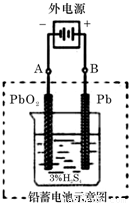
查看答案和解析>>
科目:
来源:2011-2012学年江苏省宿迁市泗洪县洪翔中学高二(下)期中化学试卷(解析版)
题型:填空题
已知KMnO
4、MnO
2在酸性条件下均能将草酸钠(Na
2C
2O
4)氧化:
2MnO
4-+5C
2O
42-+16H
+=2Mn
2++10CO
2↑+8H
2O
MnO
2+C
2O
42-+4H
+=Mn
2++2CO
2↑+2H
2O
某研究小组为测定某软锰矿中MnO
2的质量分数,准确称取1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中并定容;从中取出25.00mL待测液置于锥形瓶中,再用0.0200mol?L
-1KMnO
4标准溶液进行滴定,当滴入20.00mLKMnO
4溶液时恰好完全反应.试回答下列问题:
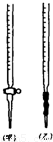
(1)0.0200mol?L
-1KMnO
4标准溶液应置于
(选填“甲”或“乙”)滴定管中;滴定终点如何判断
.
(2)你能否帮助该研究小组求得软锰矿中MnO
2的质量分数
(选填“能”或“否”).若回答“能”,请给出计算结果
;若回答“否”,试说明原因
.
(3)若在实验过程中存在下列操作,其中会使所测MnO
2的质量分数偏小的是
.
A.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
B.滴定前尖嘴部分有一气泡,滴定终点时消失
C.定容时,俯视刻度线
D.滴定前仰视读数,滴定后俯视读数
E.锥形瓶水洗之后未用待测液润洗.
查看答案和解析>>
科目:
来源:2011-2012学年江苏省宿迁市泗洪县洪翔中学高二(下)期中化学试卷(解析版)
题型:解答题
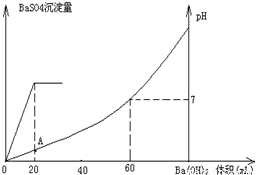
常温下,向20mL硫酸和盐酸混合溶液中加入0.05mol/L的Ba(OH)
2溶液时,生成BaSO
4沉淀量及溶液pH发生如图所示的变化.
(1)开始时混合溶液中硫酸和盐酸的物质的量浓度各是多少?
(2)在A点溶液的pH是多少?
查看答案和解析>>


 2PbSO4+2H2O
2PbSO4+2H2O

