
科目: 来源:2012-2013学年江苏省泰兴市高三(上)期中化学试卷(解析版) 题型:选择题
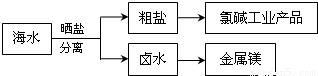
查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰兴市高三(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰兴市高三(上)期中化学试卷(解析版) 题型:选择题
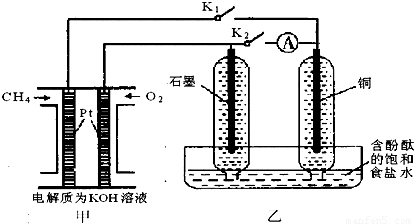
查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰兴市高三(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰兴市高三(上)期中化学试卷(解析版) 题型:选择题
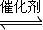 C(g),△H<0.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示.下列说法不正确的是( )
C(g),△H<0.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示.下列说法不正确的是( )
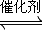 2C(g)
2C(g)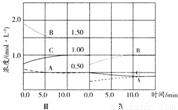 如图表示的第IV阶段是第Ⅲ阶段体系达到平衡后,将容器的体积扩大一倍体系中各物质的浓度随时间
如图表示的第IV阶段是第Ⅲ阶段体系达到平衡后,将容器的体积扩大一倍体系中各物质的浓度随时间查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰兴市高三(上)期中化学试卷(解析版) 题型:解答题
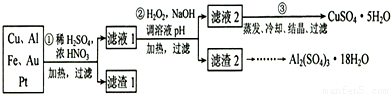
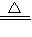 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰兴市高三(上)期中化学试卷(解析版) 题型:解答题
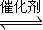 2CO2+N2.
2CO2+N2.| 时间(s) | 1 | 2 | 3 | 4 | 5 | |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | ______ | ______ | ______ | 124 |
| Ⅲ | 350 | ______ | ______ | 124 |
查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰兴市高三(上)期中化学试卷(解析版) 题型:解答题
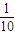 用浓度为0.200mol?L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积29.80mL.计算产品中Fe3+和Fe2+的物质的量之比.(写出计算过程)
用浓度为0.200mol?L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积29.80mL.计算产品中Fe3+和Fe2+的物质的量之比.(写出计算过程)查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰兴市高三(上)期中化学试卷(解析版) 题型:解答题

查看答案和解析>>
科目: 来源:2012-2013学年江苏省泰兴市高三(上)期中化学试卷(解析版) 题型:解答题
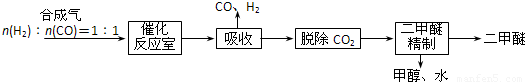
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CH3OCH3、1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 吸收a kJ | 放出b kJ | 放出c kJ |
| 平衡时体积(L) | V1 | V2 | V3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
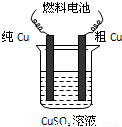
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com