
科目: 来源:不详 题型:单选题
| A.c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) |
| B.c(CH3COO-)>c(H+)>c(CH3COOH)>c(Cl-) |
| C.c(CH3COO-)=c(Cl-)>c(H+)>c(CH3COOH) |
| D.c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-) |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.c (OH-)>c (H+) |
| B.c (CH3COOH)+c (CH3COO- )=0.2 mol/L |
| C.c (CH3COOH)>c (CH3COO- ) |
| D.c (CH3COO- )+c (OH- )=0.2 mol/L |
查看答案和解析>>
科目: 来源:不详 题型:问答题
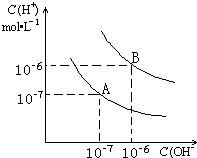
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.酸性:苯酚<氢氧化铝<碳酸 |
B.结合质子的能力: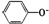 <HCO3-<CO32-<AlO2 |
| C.同温、同浓度下溶液碱性强弱:偏铝酸钠>碳酸钠>苯酚钠>碳酸氢钠 |
| D.相同pH的下列溶液其物质的量浓度:碳酸氢钠>碳酸钠>苯酚钠>偏铝酸钠 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.:①②③④ | B.:②③④ | C.:①④ | D.:②④ |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.相同温度时,1mol/L氨水与0.5mol/L氨水中,C(OH-)之比是2:1 |
| B.1mol/L NH4Cl溶液中 c (NH4+)=c (Cl-) |
| C.0.1mol/LCH3COONa溶液中加少量CH3COOH溶液,使溶液呈中性,此时混合液中c (Na+)=c (CH3COO-) |
| D.硫化钠溶液中,c (Na+)=2 c (S2-) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.在0点时,醋酸不导电 |
| B.a、b、c三点,a点时醋酸溶液中H+浓度最小 |
| C.b点时,醋酸电离程度最大 |
| D.可通过微热的方法使c点溶液中c(CH3COO-)增大 |
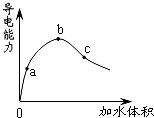
查看答案和解析>>
科目: 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com