

科目: 来源:2017届河南省高三上第一次周练化学试卷(解析版) 题型:推断题
〔化学——选修5:有机化学基础〕
某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。
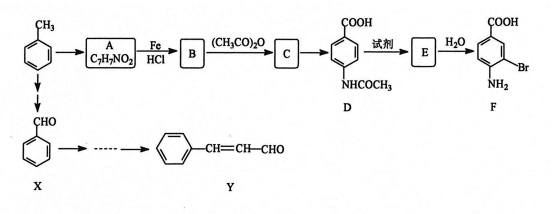
已知: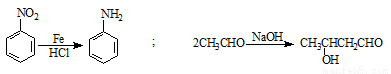
请回答下列问题:
(1)下列有关F的说法正确的是 。
A.分子式是C7H7NO2Br
B.可以和盐酸反应生成盐
C.不能形成高分子化合物
D.1 mol的 F最多可以和2 mol NaOH反应
(2)C→ D的反应类型是 。
(3) B→C的化学方程式是 。在合成F的过程中,B→C步骤不能省略,理由是 。
(4)D→E反应所需的试剂是 。
(5)写出3个同时符合下列条件的A的同分异构体的结构简式 。
①苯环上只有两种不同化学环境的氢原子 ②分子中含有能发生银镜反应的官能团
(6)以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图:
查看答案和解析>>
科目: 来源:2017届湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,7.8gNa2S固体和7.8gNa2O2固体中含有的阴离子数目均为0.1NA
B.在标准状况下,22.4LCl2和HCl的混合气体中含有的分子总数为2×6.02×1023
C.含1molFeCl3的饱和溶液滴入沸水中得到胶体数目为NA
D.标准状况下,Na2O2与足量的CO2反应生成2.24LO2,转移电子数为0.4NA
查看答案和解析>>
科目: 来源:2017届湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
根据下表信息,判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
元素代号 | G | L | M | Q | R | T |
原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
主要化合价 | +1 | +2 | +3 | +6、﹣2 | +5、﹣3 | ﹣2 |
A.单质的还原性:G<L<M B.非金属性:T<Q
C.气态氢化物的稳定性:R>T D.L2+与T2﹣的核外电子数相等
查看答案和解析>>
科目: 来源:2017届湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
某溶液能与锌片作用产生H2,则该溶液中可以大量共存的离子组是
A.Na+、NO3﹣、K+、Fe2+ B.Fe2+、Na+、SO42﹣、K+
C.K+、I﹣、NO3﹣、H+ D.NH4+、NO3﹣、Na+、HCO3﹣
查看答案和解析>>
科目: 来源:2017届湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量
②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量
下列叙述正确的是
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B.氢气和氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C.氢气和氯气反应生成2mol氯化氢气体,反应的△H=﹣183kJ/mol
D.氢气和氯气反应生成1mol氯化氢气体,反应的△H=﹣183kJ/mol
查看答案和解析>>
科目: 来源:2017届湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
已知还原性Cl-< Br-< Fe2+<I-,氧化性Cl2>Br2>Fe3+> I2,则下列说法正确的是
A.在含有 Br-、Fe2+、I-的溶液中欲只氧化I-而不氧化Br-、Fe2+,可用FeBr3作试剂
Br-、Fe2+、I-的溶液中欲只氧化I-而不氧化Br-、Fe2+,可用FeBr3作试剂
B.向FeI2溶液中通入少量Cl2,反应的离子方程式为:2Fe2++ Cl2=2Fe3++ 2C1-
C.向FeBr2溶液中通入足量Cl2,反应的离子方程式为:2Fe2+ +2Br-+2Cl2=2Fe3++ Br2+4Cl-
D.向FeCl2溶液中滴加足量碘水,能发生反应:2Fe2++ I2=2Fe3++ 2I-,
查看答案和解析>>
科目: 来源:2017届湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
某溶液中可能含有OH﹣ , CO32﹣ , AlO2﹣ , SiO32﹣ , SO42﹣ , K + , Na + , Fe3 + , Mg2 + , Al3 + 等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是
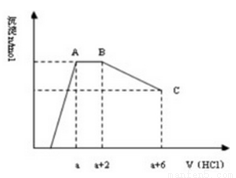
A.原溶液中一定含有Na2SO4
B.反应后形成的溶液溶质为NaCl
C.原溶液中含有CO32﹣与AlO2﹣的物质的量比为3:4
D.原溶液中一定含有的离子是OH﹣,CO32﹣,SiO32﹣,AlO2﹣,K +
查看答案和解析>>
科目: 来源:2017届湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
根据如图的转化关系判断下列说法正确的是(反应条件已略去)

A. 反应①②③④⑤均属于氧化反应和离子反应
B.反应⑤说明该条件下铝的还原性强于锰
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D.反应①中氧化剂与还原剂的物质的量之比为1:4
查看答案和解析>>
科目: 来源:2017届湖南省高三上学期第二次月考化学试卷(解析版) 题型:实验题
以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为____________mol。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中。“废渣2”中含有_____________。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+
 R4V4O12+4OH?(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈___________性(填“酸”“碱”“中”)。
R4V4O12+4OH?(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈___________性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目: 来源:2017届湖南省高三上学期第二次月考化学试卷(解析版) 题型:实验题
从废钒催化剂(主要成分V2O5、Fe2O3和SiO2等)中回收XO5的一种生产工艺流程示意如图所示:
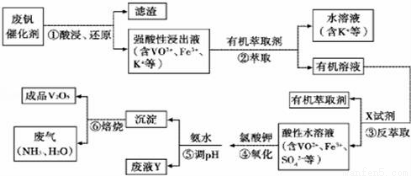
回答下列问题:
(1)①中滤渣的主要成分是 .
(2)②、③中的变化过程可简化为(下式中Rn+表示VO2+或Fe3+,HA表示有机萃取 剂的主要成分):
Rn+(水层)+nHA(有机层) RAn(有机层)+nH+(水层)
RAn(有机层)+nH+(水层)
②中萃取时必须加入适量碱,其原因是 .③中反萃取时加入的X试剂是 .
(3)完成④中反应的离子方程式: ClO3-+ VO2++ H+= VO3++ Cl-+
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如表
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钡沉淀率/% | 88 | 92 | 93 | 95 | 95 | 95 | 93 | 90 | 87 |
根据表中数据判断,⑤中加入氨水,调节溶液pH最佳值为 ;若钒沉淀率为90%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< .(已知:25℃时,Ksp[Fe(OH)3]=4.0×10﹣38)
(5)在整个工艺流程中,可以循环利用的物质是水、 和 .
(6)写出废液Y中除H+之外的两种阳离子 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com