
科目: 来源:2017届广东省高三上9月月考化学试卷(解析版) 题型:推断题
邻羟基桂皮酸是合成香精的重要原料,下为合成邻羟基桂皮酸的路线之一
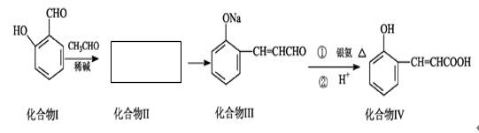
已知: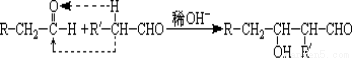
试回答下列问题:
(1)化合物II的结构简式为: 。
(2)化合物II→化合物III的有机反应类型 。
(3)化合物III在银氨溶液中发生反应化学方程式 。
(4)有机物X为化合物IV的同分异构体,且知有机物X有如下特点:①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。请写出化合物X的结构简式 。
(5)下列说法正确的是( )
A. 化合物I遇氯化铁溶液呈紫色
B. 化合物II能与NaHCO3溶液反应
C. 1mol化合物IV完全燃烧消耗9.5molO2
D. 1mol化合物III能与3 mol H2反应
(6)有机物R(C9H9ClO3)经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为 。
查看答案和解析>>
科目: 来源:2017届广西省等三校高三上8月联考化学卷(解析版) 题型:选择题
下列实验对应的现象及结论均正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | SO2通入BaCl2溶液,然后滴入稀硝酸 | 有白色沉淀,白色沉淀不溶于稀硝酸 | 所得沉淀为BaSO3,后转化为BaSO4 |
B | 浓硫酸滴入蔗糖中,并搅拌 | 得黑色蓬松的固体并有刺激性气味 | 该过程中浓硫酸仅体现吸水性和脱水性 |
C | 向FeCl2溶液中加入Na2O2粉末 | 出现红褐色沉淀和无色气体 | FeCl2溶液部分变质 |
D | 向足量含有淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
查看答案和解析>>
科目: 来源:2017届广西省等三校高三上8月联考化学卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.将1mol明矾晶体完全溶于水制成胶体,其中所含胶体粒子数目为NA
B.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA
C.0.1 mol·Lˉ1 CaCl2溶液中含有Clˉ离子的数目为0.2NA
D.136g熔融的KHSO4中含有2NA个阳离子
查看答案和解析>>
科目: 来源:2017届广西省等三校高三上8月联考化学卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为24.X的原子半径比Y大,Y与Z同主族,Y原子的最外层电子数是电子层数的3倍,下列说法正确的是
A. Y元素形成的单核阴离子还原性强于X元素形成的单核阴离子还原性
B. Z元素的简单气态氢化物的沸点比Y的氢化物沸点高
C. W元素氧化物对应水化物的酸性一定强于Z元素氧化物对应水化物的酸性
D. X的气态氢化物可与其最高价含氧酸反应生成离子化合物
查看答案和解析>>
科目: 来源:2017届广西省等三校高三上8月联考化学卷(解析版) 题型:选择题
工业上可由乙苯生产苯乙烯: ,下列说法正确的是
,下列说法正确的是
A. 可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯
B. 苯乙烯能使溴水褪色,原因是两者发生了氧化反应
C. 该反应的反应类型为消去反应
D. 乙苯和苯乙烯分子内共平面的碳原子数最多均为7
查看答案和解析>>
科目: 来源:2017届广西省等三校高三上8月联考化学卷(解析版) 题型:选择题
下列有关说法中正确的是
A. 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3·H2O)>K(HCN)
B. 由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存
C. 已知Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
D. 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
查看答案和解析>>
科目: 来源:2017届广西省等三校高三上8月联考化学卷(解析版) 题型:选择题
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如右图所示,下列说法正确的是
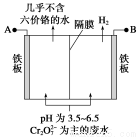
A.A为电源负极
B.阳极区溶液中发生的氧化还原反应为Cr2O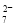 +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
C.阴极区附近溶液pH降低
D.若不考虑气体的溶解,当收集到13.44L H2 (标准状况)时,有0.2molCr2O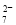 被还原
被还原
查看答案和解析>>
科目: 来源:2017届广西省等三校高三上8月联考化学卷(解析版) 题型:实验题
铵明矾是一种广泛应用于医药、食品、污水处理等多个行业的重要化工产品。以高岭土(含SiO2、Al2O3、少量Fe2O3等)为原料制备硫酸铝晶体[Al2(SO4)3·18H2O]和铵明矾[NH4Al(SO4)2·12H2O]的实验方案如下图所示。

请回答下列问题:
(1)高岭土首先需要灼烧,实验室灼 烧高岭土所需的实验仪器有 (填字母)。
烧高岭土所需的实验仪器有 (填字母)。
A蒸发皿 B泥三角 C漏斗 D酒精灯 e三脚架 f坩埚 g烧杯 h试管
(2)写出酸溶过程中发生反应的离子方程式: 。
(3)检验滤液2中是否含有Fe3+的实验方法为:  ;滤渣2的主要成分为: (填化学式)。
;滤渣2的主要成分为: (填化学式)。
(4)滤液2→ 硫酸铝晶体的操作包含的实验步骤有: 、 、 、洗涤、干燥。
硫酸铝晶体的操作包含的实验步骤有: 、 、 、洗涤、干燥。
(5)中和结晶操作是将过滤出硫酸铝晶体后的滤液,先用硫酸调节酸铝比(溶液中游离硫酸和硫酸铝的物质的量之比),再用氨水中和至一定的pH值即可析出铵明矾晶体,写出该过程中的总反应方程式: 。
查看答案和解析>>
科目: 来源:2017届广西省等三校高三上8月联考化学卷(解析版) 题型:填空题
亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g) 2C1NO(g),
2C1NO(g),
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
① 2NO2(g)+NaC1(s) NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
② 4NO2(g)+2NaC1(s) 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③ 2NO(g)+C12(g) 2C1NO(g) K3
2C1NO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):

则2NO(g)+C12(g) 2C1NO(g)反应的△H和a的关系为△H=________kJ/mol。
2C1NO(g)反应的△H和a的关系为△H=________kJ/mol。
(3)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在 不同温度下测得c(C1NO)与时间的关系如图A:
不同温度下测得c(C1NO)与时间的关系如图A:

① 由图A可判断T1 T2,该反应的△H________0 (填“>”“<”或“=”)。
 ② 反应开始到10min时NO的平均反应速率v(NO)=____________mol/(L·min)。
② 反应开始到10min时NO的平均反应速率v(NO)=____________mol/(L·min)。
③ T2时该反应的平衡常数K=____________。
(4) 一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是________点。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com