
科目: 来源: 题型:
【题目】实验:①![]()
![]() 溶液和
溶液和![]() 溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;
溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;
②向b中滴加3滴饱和![]() 溶液,溶液颜色加深;
溶液,溶液颜色加深;
③再向上述b溶液中滴加3滴![]() 溶液,溶液颜色变浅且出现浑浊;
溶液,溶液颜色变浅且出现浑浊;
④向c中逐渐滴加![]() 溶液
溶液![]() ,溶液颜色先变深后变浅。
,溶液颜色先变深后变浅。
下列分析不正确的是
A. 实验②中增大![]() 浓度使平衡
浓度使平衡![]() 正向移动
正向移动
B. 实验③中发生反应: ![]()
C. 实验③和④中溶液颜色变浅的原因相同
D. 实验②、③、④均可说明浓度改变对平衡移动的影响
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1)实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了_________________(填“促进”、“抑制”)水解。氯化铁水溶液呈______(填“酸”、“中”、“碱”)性,常温时的pH _____7(填“>”、“=”、“<”),原因是(用离子方程式表示):______________________________。
(2)常温下,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,恰好反应生成正盐,混合溶液的pH=10.反应生成正盐的化学式为___________ ,该盐中___________(填离子符号)一定能水解,其水解的离子方程式为____________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:甲:![]() 乙:
乙:![]() 其中能表明甲、乙容器中反应都达到平衡状态的是
其中能表明甲、乙容器中反应都达到平衡状态的是
A. 恒温时,气体压强不再改变
B. 断裂氢氧键速率是断裂氢氢键速率的2倍
C. 混合气体密度不变
D. 单位时间内,消耗水蒸气质量与生产氢气质量比为9:1
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A. 31d和33d属于同种核素
B. 气态氢化物的稳定性:a>d>e
C. b、c的最高价氧化物对应水化物可以反应
D. a和b形成的化合物不可能含共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】盐酸利多卡因(F)可用于急性心肌梗塞后室性早搏和室性心动过速,合成路线如下:
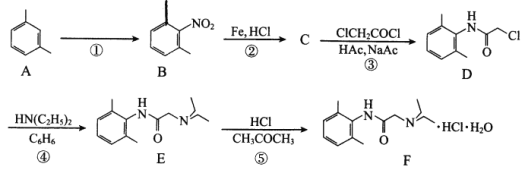
回答下列问题:
(1)A的化学名称为_________。
(2)反应①所需试剂、条件分别为_________、_________。
(3)B的同分异构体种类很多,符合以下条件的B的同分异构体共有_________种(不考虑立体异构)、其中官能团的名称是_________。
①属于苯的衍生物,苯环上共有三个取代基;
②与碳酸氢钠溶液反应可放出CO2气体。
(4)C的结构简式为_________。
(5)在反应①~⑤中属于取代反应的有_________。
(6)ClCH2COCl与足量NaOH溶液共热充分反应的化学方程式为_________。
(7)NH(C2H5)2在核磁共振氢谱上有_________组峰,峰面积比为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、钴、镍具有相似的性质,在化学上称为铁系元素。回答下列问题:
(1)LiCoO2、 LiFePO4常用作锂离子电池的正极材料。基态Co原子核外电子排布式为_________,第四电离能I4(Co) _________I4(Fe)(填“>”或“<”),PO43-的空间构型为_________。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基配合物。
与CO互为等电子体的分子和离子分别为_________和_________(各举一种,填化学式);在CO分子中,键与π键数目之比为_________。
(3)铁与K2O、 (环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,C原子的杂化轨道类型为_________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________化合物。
(环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,C原子的杂化轨道类型为_________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________化合物。
(4)铁单质的堆积方式有两种,其剖面图分别如图a、b所示。
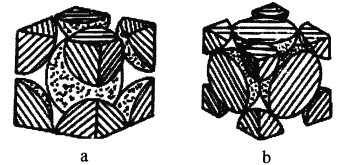
在图a所示堆积方式里铁原子的半径为rpm,则其晶胞棱长为_________cm。
在图b所示堆积方式里铁原子的总体积占晶体体积的比例为_________(用含圆周率π的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
I.CO可用于高炉炼铁,已知
Fe3O4(s)+4CO(g)====3Fe(s)+4CO2(g) △H1 =a kJ/ mol
3Fe2O3(s)+CO(g)====2Fe3O4 (s)+CO2(g) △H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)的△H3=_________kJ/mol(用含a、b的代数式表示)
Ⅱ.一定条件下,CO2和CO可以互相转化。
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
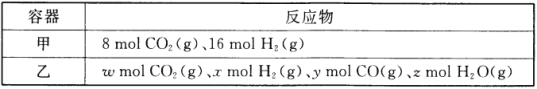
甲容器15min后达到平衡,此时CO2的转化率为75%。则0~15min内平均反应速率v(H2)= _________,此条件下该反应的平衡常数K=_________。
欲使平衡后乙与甲中相同组分气体的体积分数相等,则ω、x、y、z需满足的关系是_________,且_________ (用含y的等式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g) ![]() C6H5CH=CH2(g)+CO(g)+H2O(g) △H”中乙苯的平衡转化率影响如下图所示:
C6H5CH=CH2(g)+CO(g)+H2O(g) △H”中乙苯的平衡转化率影响如下图所示:

则△H_________ 0(填“>”“<”或“=”),压强p1、p 2、p3从大到小的顺序是_________。
(3)CO可被NO2氧化:CO+NO2![]() CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为_________。
CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)反应m A+n B ![]() p C在某温度下达到平衡。
p C在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系__________。
②若A、B、C都是气体,且m + n < p,而加压或升温平衡移动方向相同,则△H ______0
(2)将1molN2和4molH2充入容积为2L的密闭容器中发生:N2(g)+ 3H2(g) ![]() 2NH3(g) ,2分钟后反应达平衡后,N2的浓度为0.25 mol/L,完成:
2NH3(g) ,2分钟后反应达平衡后,N2的浓度为0.25 mol/L,完成:
①N2转化率是____________
②用NH3 表达的化学反应速率为:___________
③平衡常数值是________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.在有机化合物中,每个碳原子周围都有4对共用电子对
B.在有机化合物中,碳原子能形成单键、双键、叁键,还可形成其它形式的共价键
C.在有机化合物中,碳、氢原子之间只能形成单键
D.在有机化合物中,碳、氮原子之间只能形成单键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com