
科目: 来源: 题型:
(6分)请根据反应 Fe + CuSO4 = Fe SO4 + Cu,设计原电池,完成以下问题。
负极: , 其电极反应式为:
正极: , 其电极反应式为:
电解质溶液: , 电池的离子反应式为:
查看答案和解析>>
科目: 来源: 题型:
用50mL 0.50mol?L![]() 盐酸和50mL 0.55 mol?L
盐酸和50mL 0.55 mol?L![]() NaOH溶液进行中和热测定的实验。实验中测得起始温度为20.1℃,终止温度为23.4℃,反应后溶液的比热容为4.18 J?g-1?℃-1,盐酸和NaOH溶液的密度都近似认为是1 g?cm
NaOH溶液进行中和热测定的实验。实验中测得起始温度为20.1℃,终止温度为23.4℃,反应后溶液的比热容为4.18 J?g-1?℃-1,盐酸和NaOH溶液的密度都近似认为是1 g?cm![]() ,则中和热为
,则中和热为
A.54.8 kJ?mol![]() B.55.2 kJ?mol
B.55.2 kJ?mol![]() C.56.5 kJ?mol
C.56.5 kJ?mol![]() D.57.3 kJ?mol
D.57.3 kJ?mol![]()
查看答案和解析>>
科目: 来源: 题型:
A和B两种元素的原子,当它们分别获得1个电子形成稀有气体原子的电子层结构时, A放出的能量大于B,则可推断
A.A的氧化性小于B B.A-还原性大于B-
C.B-的还原性大于A- D.A的还原性大于B
查看答案和解析>>
科目: 来源: 题型:
日常所用干电池的电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2氧化吸收H2),电极反应可简化为:Zn-2e-=Zn2+;2NH4++2e-=2NH3+H2(NH3再用于结合Zn2+)。
根据上述叙述判断下列说法中正确的是
A.干电池中Zn为正极,碳为负极
B.干电池工作时,电流由Zn极经外电路流向碳极
C.干电池长时间连续使用时内装糊状物可能流出腐蚀电器
D.干电池可以实现化学能向电能的转化和电能向化学能的转化
查看答案和解析>>
科目: 来源: 题型:
化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面的说法错误的是
A.能够节约原料和能源 B.能够提高产品的产量
C.能够提高经济效益 D.能够提高化学反应速率
查看答案和解析>>
科目: 来源: 题型:
下列说法错误的是
A.化学反应实质是旧键断裂新键形成
B.极性键就是共用电子对发生偏移的共价键
C.氢键是一种比较弱的化学键
D.水结冰时体积膨胀、密度减小就是因为氢键的存在
查看答案和解析>>
科目: 来源: 题型:
在一定条件下发生反应:3A(g) + 2B(g)![]() xC(g) + 2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡。此时C的浓度为0.8mol/L,又测得反应速率vB = 0.2 mol /(L ? min )。试求算:
xC(g) + 2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡。此时C的浓度为0.8mol/L,又测得反应速率vB = 0.2 mol /(L ? min )。试求算:
(1)x的值;
(2)达平衡时A的浓度;
(3)A、B的转化率之比 。
查看答案和解析>>
科目: 来源: 题型:
(10分)如图所示,组成一个原电池。
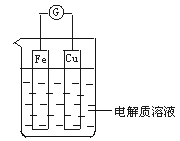 (1)当电解质溶液为稀硫酸时:
(1)当电解质溶液为稀硫酸时:
①Fe电极是__________极,Cu电极是__________极(填“正”或“负”);
②负极的电极反应式为___________, 电池总反应的离子方程式为_____________________;
(2)当电解质溶液为稀硝酸时:
①Fe电极发生____________反应(填“氧化”或“还原”);
②Cu电极是_____极,其电极反应式为____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com