
科目: 来源: 题型:
X、Y、Z三种气体,取X和Y按2∶1的物质的量之比混合,放入固定体积的密闭容器中发生如下反应:X + 2Y ![]() 2Z,达到平衡后,X的转化率不可能为( )
2Z,达到平衡后,X的转化率不可能为( )
A.10% B.15% C.20% D.25%
查看答案和解析>>
科目: 来源: 题型:
不管化学反应过程是一步完成还是分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)===H2O(l) ΔH1=-Q1 kJ·mol-1①
C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1②
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-Q3 kJ·mol-1③
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
A.(Q1+Q2+Q3) kJ B.[0.5(Q1+Q2+Q3)] kJ
C.(0.5Q1-1.5Q2+0.5Q3) kJ D.(1.5Q1-0.5Q2+0.5Q3) kJ
查看答案和解析>>
科目: 来源: 题型:
下列叙述中,正确的是( )
①电解池是将化学能转变成电能的装置 ②原电池是将电能转变成化学能的装置 ③金属和石墨导电均为物理变化,电解质溶液导电是化学变化 ④不能自发进行的氧化还原反应,通过电解的原理有可能实现 ⑤电镀过程相当于金属的“迁移”,可视为物理变化
A.①②③④ B.③④
C.③④⑤ D.④
查看答案和解析>>
科目: 来源: 题型:
下列热化学方程式中,ΔH的绝对值能表示可燃物的燃烧热的是( )
A.C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
D.CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E、F是五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应。请回答下列问题:
(1)写出B、C、E元素的名称B 、C 、E 。
(2)写出C、D两种元素形成的原子个数比为1:1的物质的电子式为
。
(3)可以验证C和F两种元素非金属性强弱的结论是(填编号) ;
① 比较这两种元素常见单质的熔点
② 比较这两种元素的单质与氢气化合的难易程度
③ 比较这两种元素的气态氢化物的还原性
(4) A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为 、 ,这两种酸式盐相互反应的离子方程式为 。
(5)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
。
(6)向含有a mol E的氯化物的溶液中加入含b mol D的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为 。
① a mol ② b mol ③ a/3 mol
④ b/3 mol ⑤ 0 ⑥ (4a-b)mol
查看答案和解析>>
科目: 来源: 题型:阅读理解
某化学兴趣小组的同学设计了一套实验方案探究元素周期表中元素性质的变化规律:1、同一周期内从左到右元素金属性的递变规律;2、同一主族内从上到下元素非金属性的递变规律。
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| 1.钠与冷水反应,再向反应后溶液中滴加酚酞。 | A.产生白烟 |
| 2.向新制的H2S饱和溶液中滴加新制的氯水 | B.反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色。与酸反应剧烈,产生大量气泡且可以燃烧 |
| 3.镁带用砂纸打磨后在空气中燃烧 | C.产生大量气泡、气体可以燃烧 |
| 4.NaI溶液中加入溴水和CCl4 | D.下层溶液变橙色 |
| 5.镁带用砂纸打磨后与沸水反应,再向反应后溶液中滴加酚酞。镁带用砂纸打磨后与2mol/L盐酸反应。 | E.浮于水面,熔成小球,迅速向四处游动,溶液变成红色 |
| 6.蘸浓氨水与浓盐酸的两玻璃棒接近 | F.下层溶液变紫色 |
| 7.NaBr溶液中加入氯水和CCl4 | G.发出耀眼的强光,生成白色物质 |
| 8.铝片用砂纸打磨后与2mol/L盐酸反应 | H.生成淡黄色沉淀 |
回答下列问题
(1)从上表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写符合要求的答案在空格中(有几个填几个,不一定把空格填满)。
| 探究同一周期从左到右元素金属性的递变规律 | 探究同一主族内从上到下元素非金属性的递变规律 | |||||||
| Ⅰ | ||||||||
| Ⅱ | ||||||||
(2)实验结论(用元素符号表示具体的强弱顺序):
元素的金属性: ,元素的非金属性: 。
(3)上表(Ⅰ)中实验方法8反应的离子方程式
。
(4)上表(Ⅱ)中实验现象D反应的离子方程式 。
查看答案和解析>>
科目: 来源: 题型:
下图是中学教材中元素周期表的一部分,其中标出A~Q14种元素,试回答下列问题:

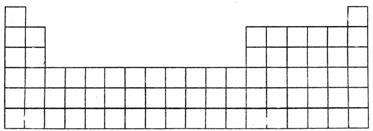
(1)在上表所列出的短周期元素中(填具体物质化学式)
①性质最不活泼的是 ;
②原子半径最小的是(除稀有气体元素) 。
③形成的气态氢化物最稳定的是 ;
④最高价氧化物对应的水化物中酸性最强的是 ,单质氧化性最强的是 。
⑤形成的阴离子还原性最弱的是 ,简单阳离子半径最小的是 。
(2)用电子式表示A与C形成的化合物的形成过程
。
(3)F与K形成的化合物溶于水所克服的微粒间作用力为 。
(4)J在元素周期表中的位置是 ,B元素形成的单质的结构式为 ,K形成简单离子的结构示意图为 。
(5)设P的原子序数为Z,则F的原子序数为 (用Z表示),Q的原子序数为 (用Z表示)。
查看答案和解析>>
科目: 来源: 题型:
a、b、c、d、e、f、g为七种由1~18号元素构成的微粒,它们都有10个电子,其结构特点如下表︰
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 多核 | 单核 | 双核 | 多核 | 多核 |
| 所带单位电荷 | 1+ | 2- | 0 | 1- | 1- | 0 | 1+ |
其中b的离子半径大于d的离子半径;c是四原子分子;e与g加热可形成c和f两种分子。试写出:
(1)c分子的电子式为 ;a和e两种粒子组成化合物的电子式为 。
(2)e与g加热形成c和f的离子方程式 。
(3)a的单质与f反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com