
科目: 来源: 题型:
下列说法正确的是
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.任何能使熵值增大的过程都能自发进行
C.自发反应一定是熵增大,非自发反应一定是熵减小或不变
D.反应物和生成物所具有的总焓决定了反应是放热还是吸热
查看答案和解析>>
科目: 来源: 题型:
下列各离子方程式中,属于水解反应的是
A.HCO3-+H2O ![]() H3O++CO32- B.NH4++H2O
H3O++CO32- B.NH4++H2O ![]() NH3·H2O+H+
NH3·H2O+H+
C.PO43-+ H3O+![]() HPO42-+ H2O D.H2O+H2O
HPO42-+ H2O D.H2O+H2O ![]() H3O++OH-
H3O++OH-
查看答案和解析>>
科目: 来源: 题型:
对于反应A(g)+3B(g) ![]() 2C(g),下列各数据表示不同条件下的反应速率,
2C(g),下列各数据表示不同条件下的反应速率,
其中反应进行得最快的是
A.v(A)=0.2 mol·(L·s)-1 B.v(B)=0.2 mol·(L·s)-1
C.v(B)=0.3 mol·(L·s)-1 D.v(C)=0.2 mol·(L·s)-1
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
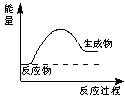 |
A. 右图所示的是一个放热反应
B. 加入催化剂v(正)增大、v(逆)减小
C. 燃烧热是生成1molH2O放出的热量
D. 只有活化分子才能发生有效碰撞
查看答案和解析>>
科目: 来源: 题型:
2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”,下列举措中违背了这一指导思想的是
A.加大开发太阳能、水能、风能、地热能等能源力度,减少化石燃料的使用
B.研制乙醇汽油(汽油中添加一定量的乙醇)技术,降低机动车辆尾气中有害气体排放
C.生产、生活中,努力实现资源的循环利用
D.利用高新技术,提高石油、煤、天然气产量,以满足工业生产快速发展的需求
查看答案和解析>>
科目: 来源: 题型:阅读理解
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)![]() N2 (g)+CO2 (g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
|
| NO | N2 | CO2 | ||
| 0 | 1.00 | 0 | 0 | ||
| 10 | 0.58 | 0.21 | 0.21 | ||
| 20 | 0.40 | 0.30 | 0.30 | ||
| 30 | 0.40 | 0.30 | 0.30 | ||
| 40 | 0.32 | 0.34 | 0.17 | ||
| 50 | 0.32 | 0.34 | 0.17 |
①0min~10min以v(CO2) 表示的反应速率为 。
②下列各项能作为判断该反应达到平衡的是 (填序号字母)。

A.容器内压强保持不变
B. 2v(NO)(正)= v(N2)(逆)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
③30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。如图表示CO 2的逆反应速率[v逆(CO 2)]随反应时间(t)的变化关系图。请在图中画出在30min改变上述条件时在40min 时刻再次达平衡的变化曲线。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol K1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol K2
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式 (写成最简整数的形式),并用K1和K2表示该反应的平衡常数K

(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(5)pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3。右图为,H2CO3在通入HCl或加入氢氧化钠固体后,平衡时溶液中三种成分的pC—pH图。由图可知:若往碳酸钠溶液加入盐酸至pH约为 时有CO2气体放出 , 若往0.001mol/L通入HCl至图中A点(为两曲线的交点,纵坐标约为3.3)时溶液中所有离子浓度从大到小关系是
查看答案和解析>>
科目: 来源: 题型:
物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 ![]() 2(t-BuNO) 。
2(t-BuNO) 。
(1)当(t-BuNO)2的起始浓度(c0)为0.50 mol·L-1时,实验测得20℃时的平衡转化率(α)是65 %。列式计算20℃时上述反应的平衡常数K = 。(保留一位小数)
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 (填“增大”、“不变”或“减小”)。
已知20℃时该反应在CCl4溶剂中的平衡常数为1.9,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率 (填“大于”、“等于”或“小于”)其在正庚烷溶剂中的平衡转化率。
(3)实验测得该反应的ΔH =+50.5kJ·mol-1,活化能Ea=+90.4 kJ·mol-1。下列能量关系图合理的是

(4)随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率。用于比色分析的仪器是 。
A.pH计 B.元素分析仪 C.分光光度计 D.原子吸收光谱仪
查看答案和解析>>
科目: 来源: 题型:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000 mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2 mL。
试回答下列问题: 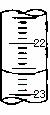
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)该小组在步骤①中的错误是 ,
由此造成的测定结果 (偏高、偏低或无影响)。
(3)右图,是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
请计算待测烧碱溶液的浓度为 mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
室温下,有pH=12的NaOH溶液100mL,若将其pH变为11 (溶液混合造成的误差忽略不计,计算结果保留小数点后一位)。
(1)若用pH=10的NaOH溶液,应加入 mL
(2)若用pH=2的盐酸,设加入的体积为amL,则a= mL保留一位小数)
(3)使用0.01mol/L的CH3COOH溶液V1mL,则V1的取值为 a(填“大于”“小于”“等于”)。
查看答案和解析>>
科目: 来源: 题型:
用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
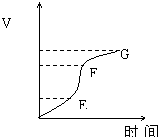 (1)实验过程如下图所示,分析判断 段化学反应速率最快, 段收集的氢气最多。这段反应速率最快的原因是 。
(1)实验过程如下图所示,分析判断 段化学反应速率最快, 段收集的氢气最多。这段反应速率最快的原因是 。
(2)为了减缓上述反应的速率但不影响产生气体的量,欲向溶液中加入下列物质,你认为可行的是
A.蒸馏水 B.氯化钠固体
C.氯化钠溶液 D.浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学 反应速率?(至少回答一种) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com