
科目: 来源: 题型:
已知反应:
①101kPa时,2C(s)+O2(g)=2CO(g);ΔH1=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);ΔH2=-57.3kJ/mol
下列结论正确的是
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀KOH溶液反应的中和热为-57.3kJ/mol
D.稀硫酸与NaOH固体反应生成1mol水的焓变大于ΔH2
查看答案和解析>>
科目: 来源: 题型:
有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀.将a、d分别投入等浓度的盐酸中,d比a反应剧烈.将Cu浸入b的盐溶液里,无明显变化.如果把Cu浸入c的盐溶液里,有c的单质析出.据此判断它们的活动性由强到弱的顺序是( )
A.d、c、a、b B.d、a、b、c C.d、b、a、c D.b、a、d、c
查看答案和解析>>
科目: 来源: 题型:
碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是( )
A.在碱金属中它具有最大的原子半径
B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸
查看答案和解析>>
科目: 来源: 题型:
下列各组中化合物的性质比较,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4 B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3<H2S< HCl D.熔沸点:H2O<H2S<H2Se<H2Te
查看答案和解析>>
科目: 来源: 题型:
下列判断正确的是
①放热反应在常温下一定很容易发生,吸热反应只有在一定条件下才可发生②反应热效应的产生是由于反应前后反应物和生成物的总键能不同造成的。③任何反应中的能量变化都表现为热量变化④反应的热效应就是焓变 ⑤由于吸热反应后体系的能量升高,因此规定吸热反应的焓变为“+ ”
A.②③④ B.①③⑤ C.①②④⑤ D. ②⑤
查看答案和解析>>
科目: 来源: 题型:
有人建议将氢元素排在元素周期表的ⅦA族。下列事实能支持这一观点的是( )
①H原子得到一个电子实现最外电子层稳定结构;②氢分子的结构式为H—H;③与碱金属元素形成离子化合物M+[∶H]-;④分子中原子间的化学键都属于非极性键
A、只有①②③ B、只有①③④ C、只有②③④ D、有①②③④
查看答案和解析>>
科目: 来源: 题型:
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。(B中装的是无水硫酸铜)

(1)装置A的作用是制取氯气,其反应的化学方程式为:
(2)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是
。
(3)①装置B的作用是 ,现象是 。
②装置C和D出现的不同现象说明的问题是 。
③装置E的作用是 。
④写出装置F中发生反应的离子方程式 。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在 与 之间(填装置字母序号),装置中应放入 试剂。
查看答案和解析>>
科目: 来源: 题型:
有A、B两种常温下有刺激性气味的气体,将A(g)通入品红溶液中,品红溶液变为无色;将B(g)通入品红溶液中,品红溶液也变为无色;将A(g)和B(g)按1:1的体积比混合充分,通入品红溶液中,品红溶液不褪色,通入紫色石蕊试液中,溶液只变红不褪色。试回答下列问题:
(1)写出A、B的化学式:____、____
(2)写出A和NaOH溶液反应的化学方程式:________
(3)写出B与NaOH溶液反应的离子方程式:________
(4)加热通入A后变为无色的品红溶液,现象是____;加热通入B后变为无色的品红溶液,现象是_____。
查看答案和解析>>
科目: 来源: 题型:
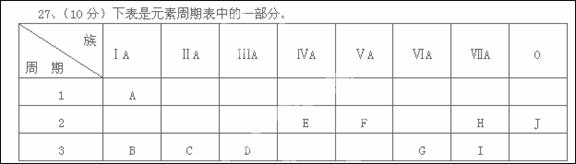 根据A—J在周期表中的位置,用元素符号或化学式回答下列问题:
根据A—J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是 ,氧化性最强的单质是 。
(2)最高价氧化物对应的水化物中,碱性最强的是 ,酸性最强的是 ,呈两性的是 。
(3)A分别与E、F、G、H、I形成的化合物中,最稳定的是 。
(4)在B、C、D、G、I中,原子半径最大的是 。
(5) 元素C与I形成的化合物的电子式的形成过程是: 。
查看答案和解析>>
科目: 来源: 题型:
氮元素的单质和常见的化合物在工、农业生产中用途广泛。
(1)工业上利用分离空气的方法得到氮气。空气各主要成分的沸点如下:
| N2 | O2[ | Ar | CO2 |
| —196°C | —183°C | —186°C | —78°C |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是 。
(2)雷雨时空气中的N2转化为NO,生成物NO是 色的气体, (填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应。NO2与水反应的化学方程式为 。
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气。
①制取氨气的化学方程为 ;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为 g。
(4)已知:4NH3+6NO![]() 5N2+6 H2O 。化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。
5N2+6 H2O 。化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。

| |
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。
①NH3与稀硫酸溶液反应的离子方程式为 ;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com