
科目: 来源: 题型:
下列各组中的物质或离子都含配位键的是( )
A.H2O、Al2Cl6 B.CO2、SO42-
C.PCl5、[Co(NH3)4Cl2]Cl D.NH4Cl、[Cu(NH3)4]SO4
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.氢键有方向性和饱和性,属于共价键
B.分子形成氢键一定使物质的熔沸点升高
C.甲醇(CH3OH)比甲硫醇(CH3SH)熔点高,原因是甲醇分子间易形成氢键
D.H2O是一种非常稳定的化合物,这是由于氢键所致
查看答案和解析>>
科目: 来源: 题型:
2001年诺贝尔化学奖授予在“手性碳原子的催化氢化、氧化反应”研究领域作出贡献的美、日三位科学家。下列分子属于手性分子的是( )
A.CHFBr2 B.CH3CH2OH
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
下列化学用语正确的是( )
A.Mg2+的结构示意图: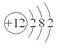 B.C2H2的电子式:
B.C2H2的电子式:![]()
C.基态Cr的价电子排布式:3d44s2 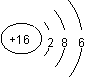
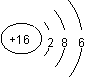
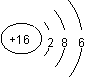
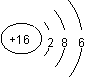 D.HClO的结构式:H—Cl—O
D.HClO的结构式:H—Cl—O
查看答案和解析>>
科目: 来源: 题型:
金晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为d m,求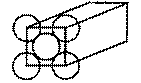
(1)金晶体中最小的一个立方体含有__________个金属原子。
(2) 欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定 ;
(3)计算一个晶胞的体积是 cm3;
(4)金的密度为_________g•cm-3。
(5)列式计算金原子的空间利用率
查看答案和解析>>
科目: 来源: 题型:
晶体具有规则的几何外形,晶体中最基本的重复
单元称之为晶胞。NaCl晶体结构如右图所示。
(1)晶体中每个Na+同时吸引着______个Cl-,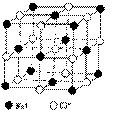
每个Cl-同时吸引着_______个Na+。
(2)晶体中在每个Cl-周围与它最接近且距离相等
的Cl-共有________个。
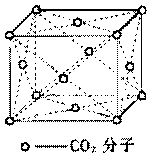
(3)在干冰晶体中每个CO2分子周围紧邻的 CO2分子有___________个, 在晶体中截取一个最小的正方形;使正方形的四个顶点部落到CO2分子的中心,则在这个正方形中有___________个C02分子。其中,C原子的杂化类型为 。C02分子中碳氧之间有π键,而SiO2中硅氧之间无π键,原因是 。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
(5)A、B、C最高价氧化物的晶体类型分别是______晶体、______晶体、______晶体
(6)画出D的核外电子排布图___________________________________________,这样排布遵循了____________原理和____________规则。
查看答案和解析>>
科目: 来源: 题型:
⑴某元素原子的价电子构型为3s23p3,它属于第__ __周期,是__ _ 族,最高正化合价为__ __,元素名称是 _ 。
⑵某元素原子的价电子构型为3s2,它是___ ___区元素,元素符号为 _ 。
⑶某元素原子的价电子构型为3d104s2,它属于第 _ 周期,是 _族, _ 区元素,元素符号是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com