
科目: 来源: 题型:
在25℃、101 kPa下,白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式分别为:P4(s) + 5O2(g) = P4O10(s);ΔH=-3093.2 kJ·mol-1
4P(s) + 5O2(g) = P4O10(s);ΔH =-2954.0 kJ·mol-1 由此判断下列说法正确的是( )
A.红磷的燃烧热为2954.0 kJ·mol-1
B.已知白磷分子为正四面体结构,则P-P键之间的夹角为109°28′
C.由红磷转化为白磷是吸热反应,等质量时白磷能量比红磷高
D.等质量的白磷和红磷在相同条件下分别与足量氯气反应,设产物只有PCl5,则红磷放出的热量更多
查看答案和解析>>
科目: 来源: 题型:
当前世界范围内都在积极发展新能源和可再生能源,走可持续发展之路。下列有关做法跟此无关的是( )
A.将氢气、酒精设计成燃料电池,是因为燃料电池具有较高的能量利用率,同时氢气、酒精等燃料可再生
B.大力开发丰富的煤炭资源,并将煤进行气化处理,提高煤的综合利用率,可减少对石油的依赖
C.开发和利用太阳能、生物质能、风能等,如在我国西部和沿海地区兴建太阳能、风力发电站等
D.合理开发利用海底可燃冰有助于缓解化石能源紧缺
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3mol气体N混合,发生如下反应:2M(g)+ 3N(g) ![]() x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
(1)用气体M来表示该反应的化学反应速率是多少?
(2)反应前后的压强比?
(3)N的转化率是多少?
(4)平衡时气体Q所占的体积分数为多少?
查看答案和解析>>
科目: 来源: 题型:
(1)钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应为:
Zn + 2OH--2e- = ZnO + H2O Ag2O + H2O + 2e- = 2Ag + 2OH-
电池的负极是 (填电极材料),正极发生的是 反应(填反应类型),
总反应式为 。
(2)图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。试回答下列问题:
①图中通过负载的电子流动方向______ (填“向左”或“向右”).
②写出氢氧燃料电池工作时正极反应方程式 :
③放电过程中,负极附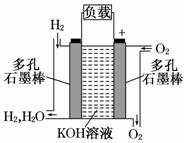 近溶液的pH (填“增大”,“减小”,“保持不变”)
近溶液的pH (填“增大”,“减小”,“保持不变”)
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E五种短周期元素的原子序数依次增大,上述元素中只有一种金属元素。A、B同周期,化合物AB2、DB2均是可使澄清石灰水变浑浊的气体。又已知C、E的单质均可溶于NaOH溶液,且C与NaOH溶液反应可产生气体。
(1)写出E元素的名称: E________
(2)画出C原子的原子结构示意图 ,写出AB2的结构式
(3)写出DB2使澄清石灰水变浑浊的化学方程式:_____________________
(4)写出E的单质与NaOH溶液反应的离子方程式: ______________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
某化学反应2A (g) ![]() B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol•L-1) 随反应时间 (min) 的变化情况如下表:
B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol•L-1) 随反应时间 (min) 的变化情况如下表:
| 实验 序号 |
时间 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | C1 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | C2 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)实验1达到平衡的时间是 min,实验4达到平衡的时间是 min.
(2)C1 C2 (填“大于”“小于” “等于”);C3= mol•L-1
(3)实验4比实验1的反应速率 (填“快”或“慢”),原因是
(4)如果2A (g) ![]() B(g) + D(g) 是一个放热反应,那么实验4与实验1相比, 放出的热量多,理由是 。
B(g) + D(g) 是一个放热反应,那么实验4与实验1相比, 放出的热量多,理由是 。
查看答案和解析>>
科目: 来源: 题型:
用下列:①H2O ②H2O2 ③Ba(OH)2 ④Na2O2 ⑤Cl2 ⑥ Ar ⑦CO2 等物质填空。 (1—4小题填序号)
(1) 由离子键和非极性键构成的是
(2) 由极性键和非极性键构成的是
(3) 不存在化学键的是
(4) 共价化合物有
(5) 写出下列物质的电子式:Na2O2
查看答案和解析>>
科目: 来源: 题型:
下列反应属于放热反应的是 属于吸热反应的是 (填字母) 。
A.铝片与稀H2SO4反应制取H2 B.碳酸钙高温分解成氧化钙和二氧化碳
C.葡萄糖在人体内氧化分解 D.氢氧化钾和硫酸中和
E.Ba(OH)2·8H2O与NH4Cl反应
查看答案和解析>>
科目: 来源: 题型:
在密闭容器中,对于反应:2SO2(g)+O2(g) ![]() 2SO3(g),SO2和O2起始时分别为20 mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量及其转化率为( )
2SO3(g),SO2和O2起始时分别为20 mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量及其转化率为( )
A.10 mol和10% B.20 mol和20% C.20 mol和40% D.20 mol和80%
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,反应:2A(s)+2B(g) ![]() C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
A.混合气的密度不再随时间而变化 B. C的质量不再改变
C.容器内的压强不随时间而变化 D. 单位时间内生成2a mol B,同时生成a molD
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com