
科目: 来源: 题型:解答题
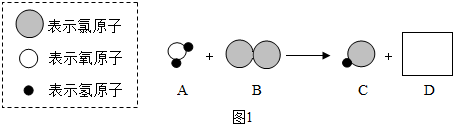
 图中的A~E表示几种初中化学常见的物质,其中C、D是单质,A、B、E是氧化物;B中两种元素的质量比为1:16.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.
图中的A~E表示几种初中化学常见的物质,其中C、D是单质,A、B、E是氧化物;B中两种元素的质量比为1:16.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

| 物质 | A | B | C | D |
| 反应前质量/g | 2 | 24.5 | 4 | 8 |
| 反应后质量/g | 16.9 | 0 | 13.6 | X |

| 实验目的 | 实验现象 | 实验结论 |
| 测定空气中氧气 的体积分数 | 白磷着火燃烧,活塞先右移,后左移,最后停在刻度约为8(填整数)的位置上. | 空气的成分按体积计算,该气体约占空气体积的21% |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
 水是一种用途很广的自然资源.
水是一种用途很广的自然资源.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验设计 | 现象 | 结论(金属的活动性) |
| A | 将铝丝放入硫酸铜溶液中 | 无现象 | Cu强于Al |
| B | 用砂纸打磨过的镁条和铜片放在空气中一段时间后,观察 | 镁条表面出现黑色物,铜片仍然保持光亮的紫红色 | Mg强于Al |
| C | 分别将锌粉与铁丝放入相同浓度的稀盐酸中 | 锌粉产生气泡的速率比铁丝快 | Zn强于Fe |
| D | 分别将铁丝与铜丝放入相同浓度的稀盐酸中 | 铁丝表面产生气泡,铜丝无现象 | Fe强于Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:填空题
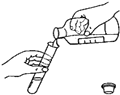 如图中,实验操作时各有三处错误,请指出并改正
如图中,实验操作时各有三处错误,请指出并改正查看答案和解析>>
科目: 来源: 题型:解答题
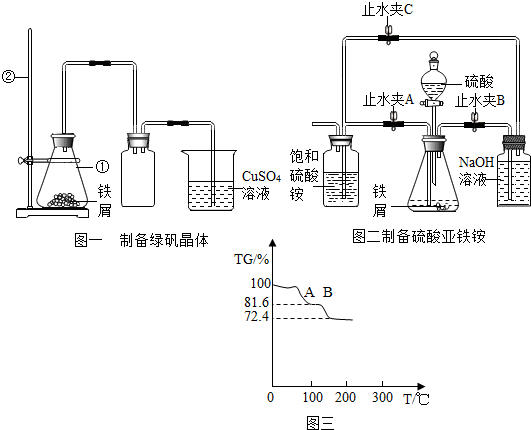
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com