
科目: 来源:福建省2018届质检化学试卷 题型:单选题
用燃着的蜡烛进行如下实验探究,下列说法不正确的是
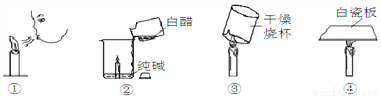
A. 实验①蜡烛因温度降低至着火点以下而熄灭
B. 实验②说明二氧化碳不能燃烧也不能支持燃烧
C. 实验③烧杯内壁有水珠说明石蜡由水等物质组成
D. 实验④白瓷板变黑说明此时有部分石蜡燃烧不完全
C 【解析】A. 实验①蜡烛因温度降低至着火点以下而熄灭,正确;B. 实验②产生了二氧化碳,该实验说明二氧化碳不能燃烧也不能支持燃烧,正确;C. 化学反应前后元素的种类不变,实验③烧杯内壁有水珠说明石蜡中含有氢元素,错误;D. 实验④白瓷板变黑说明此时有部分石蜡燃烧不完全,正确。故选C。查看答案和解析>>
科目: 来源:福建省2018届质检化学试卷 题型:单选题
下图是水在电解过程中发生变化的微观示意图,下列说法正确的是
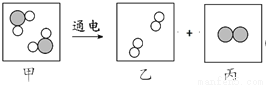
A. 与负极相连玻璃管内产生的物质是乙
B. 实验说明水是由氢气和氧气组成
C. 反应前后分子、原子种类及数目均不变
D. 甲、乙、丙三种物质的质量比是2∶2∶1
A 【解析】电解水时,正氧负氢,氢二氧一。根据反应的微观示意图,该反应中,乙是氢气,丙是氧气。A. 与负极相连玻璃管内产生的物质是氢气,正确;B. 实验说明水由氢元素和氧元素组成,错误;C. 反应前后原子种类及数目均不变,分子种类及数目发生改变,错误;D. 甲、乙、丙三种物质的质量比是9∶1∶8,错误。故选A。查看答案和解析>>
科目: 来源:福建省2018届质检化学试卷 题型:单选题
甲、乙两种物质溶解度曲线如图,下列有关说法不正确的是
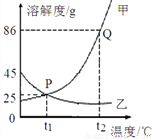
A. t1℃时,甲的饱和溶液溶质质量分数为20%
B. 甲、乙两种物质的溶解度相等
C. 若甲中混有少量的乙,可采用降温结晶的方法提纯甲
D. t2℃时,86g甲物质与100g水恰好形成饱和溶液
B 【解析】A. t1℃时,甲的溶解度是25g,饱和溶液的溶质质量分数为:×100%=20%,正确;B. 比较溶解度大小,必须指明温度,t1℃时,甲、乙两种物质的溶解度相等,错误;C. 甲的溶解度受温度影响较大,对于溶解度受温度影响较大的物质,采用降温结晶法提纯,正确;D. t2℃时,甲的溶解度是86g,86g甲物质与100g水恰好形成饱和溶液,正确。故选B。查看答案和解析>>
科目: 来源:福建省2018届质检化学试卷 题型:单选题
未经打磨的铝片放入盛有足量稀盐酸的密闭容器中,通过气压传感器测得容器内气体压强和反应时间的变化关系如图所示。下列分析不正确的是

A. a→b段气压几乎没增大,是因为铝基本未参加反应
B. b→d 气压增大是因为产生气体与反应放热综合所致
C. e点一定是容器中化学反应的结束点
D. c点时容器中溶液的溶质是HCl、AlCl3
C 【解析】密闭容器中气体增多、温度升高都能使压强变大。A. 铝表面有一层致密的氧化铝薄膜,将未经纱布打磨的铝条放入盛有稀盐酸的密闭容器中,稀盐酸先与氧化铝反应生成氯化铝和水,没有气体生成,容器内压强不变,a→b段气压几乎没增大,说明没有生成氢气,是因为铝基本未参加反应,正确;B. b→d是铝与盐酸反应生成氢气,并放出热量,所以气压增大是因为产生气体与反应放热综合所致,正确;C.d点压强最大...查看答案和解析>>
科目: 来源:福建省2018届质检化学试卷 题型:填空题
创建“水美城市”,亮出闽北名片。
(1)八闽首府建州(今建瓯),历史悠久。建瓯板鸭富含的营养素是_______。
(2)百合是南平市花。走在王台百合园区,会闻到幽幽花香。请用微粒的观点解释这一现象:_______。
(3)优质水源是酿酒条件之一,政和“东平老窖”是福建名酒。.酒精(C2H6O)属于_______。(填选项)
A.氧化物 B.碱 C.盐 D.有机物
(4)闽北各地加强环境治理,大力推广沼气池建设。沼气主要成分是甲烷(CH4),甲烷完全燃烧的化学方程式是__________。
蛋白质 微粒在不断运动 D CH4+2O22H2O+CO2 【解析】(1)肉类富含的营养素是蛋白质。(2)具有香味的分子由于不停地运动,接触到了人的嗅觉细胞而闻到香味。(3).酒精属于有机物。(4)含碳元素、氢元素的物质充分燃烧生成二氧化碳和水。查看答案和解析>>
科目: 来源:福建省2018届质检化学试卷 题型:填空题
下表是实验室配制100g某花卉营养液的组成:
硝酸钾KNO3 | 硝酸钙Ca(NO3)2 | 磷酸二氢铵NH4H2PO4 | 水H2O |
7g | 2.6g | 1.2g | 89.2g |
(1)表中物质属于复合肥的是________(写一种)。
(2)硝酸钾中氮元素的化合价是_______,在营养液中它的质量分数是________。
(3)为了加快溶解速度,可以采用的一种方法是_______。
(4)将配制好的溶液装入________(选“广口瓶”或“细口瓶”)中,并贴上标签。
硝酸钾 +5 7% 用玻璃棒搅拌 细口瓶 【解析】(1)氮、磷、钾三种元素中至少含有两种的化肥是复合肥。(2)设硝酸钾中氮元素的化合价是x,则(+1)+x+(-2)×3=0,解得x=+5。7gKNO3在100g营养液中的质量分数为:×100%=7%。(3)用玻璃棒搅拌可加快溶解速度。(4)液体存放于细口瓶中。查看答案和解析>>
科目: 来源:福建省2018届质检化学试卷 题型:填空题
人类的生活和生产都离不开金属。
(1)秦朝铸造的青铜剑经分析,其成分有铜、锡及少量的铅、铁等。青铜属于_______。
A.合成材料 B.复合材料 C.金属材料 D.非金属材料
(2)高炉炼铁的反应之一是氧化铁与一氧化碳反应,写出这个反应的化学方程式_______。
(3)公园的铁制扶手栏杆容易锈蚀,防锈方法之一是_______。铝的金属活动性比铁强,但铝不容易锈蚀,原因是_______。
(4)参考钠原子的结构示意图 ,画出钠离子(Na+)的结构示意图_______。
,画出钠离子(Na+)的结构示意图_______。
(5)钛酸锂(Li4Ti5O12)是制造锂电池的材料之一,其中锂、钛两种元素的质量比是______,配平制取钛酸锂的化学方程式:___TiO2+ ___Li2CO3 高温___Li4Ti5O12+___CO2↑
C Fe2O3+3CO 2Fe+3CO2 涂油漆 铝的表面有一层致密的氧化物 7∶60 5 2 1 2 【解析】(1)金属材料包括纯金属单质以及它们的合金,青铜属于合金,属于金属材料,故选C。(2)高炉炼铁的化学方程式为:Fe2O3+3CO 2Fe+3CO2 (3)铁生锈是铁与氧气、水共同作用的结果,在铁制品表面喷漆、涂油或镀一层其它的金属都可以防止铁制品生锈。铝在空气中与氧气反应,其表面生...查看答案和解析>>
科目: 来源:福建省2018届质检化学试卷 题型:推断题
现有五瓶失去标签的无色溶液,它们分别是稀盐酸、氢氧化钠溶液、氢氧化钙溶液、氯化钠溶液和碳酸钠溶液。探究小组进行如下的分析实验:
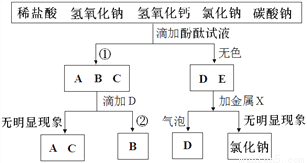
(1)①中的颜色是_______。
(2)“加金属X”产生“气泡”的化学方程式是_______,“金属X”不能是铜的原因是______。
(3)②中观察到的现象是_______。
(4)经研究分析,将第一步实验中的酚酞试液改为_______,就可直接鉴别出D、E。
(5)可以用B试剂来鉴别A与C,请写出操作方法、观察到的实验现象及结论_______。
红色 Zn+2HCl=ZnCl2+H2↑ 铜的金属活动性弱不能置换酸中的氢 有气泡产生 石蕊试液 将碳酸钠溶液(即B)分别滴入A、C两种溶液中,若有白色沉淀产生的是氢氧化钙 【解析】(1)酚酞溶液遇中性或酸性溶液不变色,遇碱性溶液变红,所以①中的颜色是红色。(2)D、E中一种物质是HCl,一种物质是NaCl,其中HCl能与金属反应生成氢气而冒气泡,故D是HCl,X是金属活动性顺序中氢前的金属...查看答案和解析>>
科目: 来源:福建省2018届质检化学试卷 题型:实验题
(1)如图是实验室制取气体的常用装置。

①写出图中标注仪器的名称:a__________,b___________。
②制取氧气,发生装置选用________,发生反应的化学方程式是____________。
③用B装置制取二氧化碳气体,首先往锥形瓶中加入的药品是_________,选用的收集装置是________。
(2)有同学认为这样收集到的二氧化碳气体纯度不高,他设计如图所示装置,测定瓶中二氧化碳气体的体积分数。

①检查该装置气密性。
②用量筒等仪器测量集气瓶的容积,其方法是:记下塞子塞入集气瓶的位置线,取下塞子,接着___________, 由此测得集气瓶的容积为260 mL。
③吹干集气瓶后集满一瓶二氧化碳气体。
④塞上塞子,将50mL氢氧化钠溶液注入集气瓶中并轻摇,发生反应的化学方程式是__________,一段时间后打开止水夹,测得集气瓶内液体体积为156 mL,该瓶气体中二氧化碳气体的体积分数是_______。
⑤根据以上探究过程,请你评价“这样收集二氧化碳气体方法”的优点和不足(各一点):_______。
酒精灯 锥形瓶 A 石灰石 C 往瓶中加水至位置线后,将水倒入量筒测量水的体积即为集气瓶的容积 2NaOH+CO2==Na2CO3+H2O 60% 向上排空气法收集二氧化碳气体其优点是操作简单,不足是收集到的气体纯度不高 【解析】(1)①a是酒精灯;b是锥形瓶。②实验室往往用加热高锰酸钾的方法制取氧气。加热固体制取气体,选择发生装置A,2KMnO4 △ K2MnO4 + MnO2 + O2↑...查看答案和解析>>
科目: 来源:福建省2018届质检化学试卷 题型:计算题
硫化钠(Na2S)可用于皮革、染料工业等。工业上可用氢氧化钠溶液吸收燃煤产生的硫化氢(H2S)气体制造硫化钠,化学反应方程式如下:H2S+2NaOH==Na2S+2H2O。用此法生产3.9 t 硫化钠至少需消耗溶质质量分数为10%的氢氧化钠溶液多少t?
40 t 【解析】设生产3.9 t 硫化钠至少需消耗溶质质量分数为10%的氢氧化钠溶液的质量是x。 H2S+2NaOH==Na2S+2H2O 80 78 10%×x 3.9 t =,解得t= 40 t查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com