
科目: 来源:广东省高考真题 题型:填空题
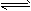 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。 查看答案和解析>>
科目: 来源:河南省期中题 题型:填空题
 H++A2- 回答下列问题:
H++A2- 回答下列问题:查看答案和解析>>
科目: 来源:安徽省模拟题 题型:单选题
查看答案和解析>>
科目: 来源:专项题 题型:单选题
A.BOH溶于水,其电离方程式是BOH=B++OH-
B.若一定量的上述两溶液混合后pH=7,则c(A-)=c(B+)
C.在0.1 mol/L BA溶液中,((B+)>c(A-)>c(OH-)>c(H+)
D.若将0.1 mol/L BOH溶液稀释至0.001 mol/L,则溶液的pH=9
查看答案和解析>>
科目: 来源:模拟题 题型:填空题

为了鉴别上述化合物,分别完成以下实验:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B_________D__________。
(2)将含1 mol A的溶液与含1 mol E的溶液混合,所得溶液中所有离子的浓度由大到小的顺序是_______________________。
(3)写出实验②发生反应的离子方程式___________________。
(4)向含1mol C的溶液中滴加1000 mL 2 mol/L Ba(OH)2溶液,充分反应后溶液pH______7(填“大 于”、“小于”或“等于”),用离子方程式解释其原因_____________________。
查看答案和解析>>
科目: 来源:模拟题 题型:单选题
查看答案和解析>>
科目: 来源:专项题 题型:填空题
在纯碱溶液中滴入酚酞,所观察到的现象是 _______________________________________,
若在该溶液中逐滴加入过量的氯化钙溶液,所观察到的现象是________________________________,
其原因是(以离子方程式和简要文字说明):_______________________________________________。
查看答案和解析>>
科目: 来源:同步题 题型:填空题
查看答案和解析>>
科目: 来源:同步题 题型:不定项选择题
 H++B2-,则下列说法中一定正确的是
H++B2-,则下列说法中一定正确的是 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com