
科目: 来源:浙江省高考真题 题型:单选题

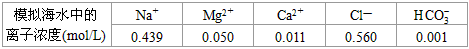
查看答案和解析>>
科目: 来源:0110 模拟题 题型:填空题
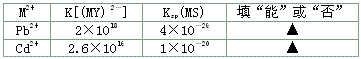
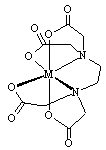
查看答案和解析>>
科目: 来源:模拟题 题型:单选题
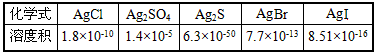
查看答案和解析>>
科目: 来源:模拟题 题型:填空题
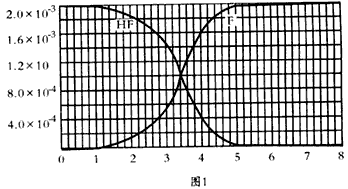
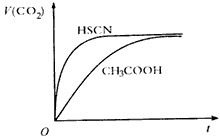
查看答案和解析>>
科目: 来源:北京期末题 题型:单选题
查看答案和解析>>
科目: 来源:北京期末题 题型:单选题
查看答案和解析>>
科目: 来源:江西省模拟题 题型:单选题
查看答案和解析>>
科目: 来源:辽宁省模拟题 题型:单选题
查看答案和解析>>
科目: 来源:河南省模拟题 题型:单选题
查看答案和解析>>
科目: 来源:0114 模拟题 题型:填空题

 CO2(g)+H2(g),得到如下三组数据
CO2(g)+H2(g),得到如下三组数据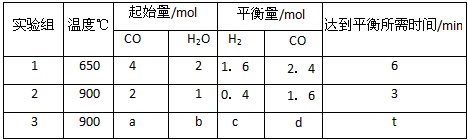

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com