
科目: 来源: 题型:
【题目】下列有关有机物的说法不正确的是
A. 糖类物质均能发生水解反应
B. 酒精中是否含有水,不能用金属钠检验
C. 蛋白质在一定条件下能发生水解反应,生成氨基酸
D. 不能用米汤直接检验加碘食盐中是否含有碘元素
查看答案和解析>>
科目: 来源: 题型:
【题目】I、从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)已知:Fe3O4(s) + CO(g)=3FeO(s) + CO2(g)ΔH1= +19.3 kJ·mol-1
3FeO(s) + H2O(g)=Fe3O4(s) + H2(g)ΔH2= -57.2 kJ·mol-1
C(s) + CO2(g)=2 CO(g)ΔH3= +172.4 kJ·mol-1
写出以铁氧化物为催化剂裂解水制氢气总反应的热化学方程式___________。
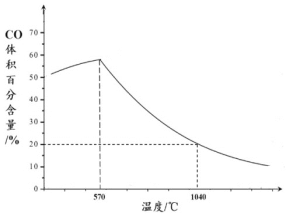
(2)下图表示其它条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。
①当温度低于570℃时,温度降低,CO的转化率__________(填“增大”、“减小”或“不变”),理由是_______________。
②当温度高于570℃时,随温度升高,反应Fe3O4(s) + CO(g)![]() 3FeO(s) + CO2(g)平衡常数的变化趋势是_________;(填“增大”、“减小”或“不变”);1040℃时,该反应的化学平衡常数的数值是____________。
3FeO(s) + CO2(g)平衡常数的变化趋势是_________;(填“增大”、“减小”或“不变”);1040℃时,该反应的化学平衡常数的数值是____________。
II、汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
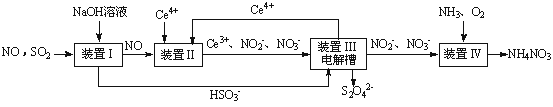
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成NO3-和NO2-物质的量之比为2:1时的离子方程式:________________________。
(2)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的____(填“阳极”或“阴极”),同时在另一极生成S2O42-的电极反应式为_________。
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1.5 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气___L(用含a代数式表示,结果保留整数,否则不给分)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5,下列说法正确的是

A.电极a为电池负极,发生还原反应
B.每消耗1molVB2转移6mol电子
C.电池工作时,OH向电极a移动
D.VB2极发生的电极反应为:2VB2+22OH-22e=V2O5+2B2O3+11H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测定某橙汁中维生素C的含量,其化学方程式为:

下列说法中,正确的是( )
A. 上述反应为取代反应 B. 滴定时可用淀粉溶液作指示剂
C. 滴定时剧烈振荡锥形瓶 D. 维生素C的分子式为C6H8O6
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.下列是某研究性学习小组对某无色水样成分的检测过程,已知该水样中只可能含有K+ 、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子,该小组同学取了100ml水样进行实验:向水样中先滴加硝酸钡溶液,再滴加1mol·L-1硝酸,实验过程中沉淀质量与所加试剂量的关系变化如下图所示:

(1)仅凭观察可知该水样中一定不含有的阳离子是________。
(2)由B点到C点变化过程中消耗硝酸的体积为__________ml。
(3)试根据实验结果推测K+是否存在_______(填“是”或“否”)若存在,其物质的量浓度的范围是______mol·L-1(若不存在,则不必回答)。
(4)设计简单实验验证原水样中可能存在的离子__________________________________(写出实验步骤、现象和结论)。
II.湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
(1)写出并配平湿法制高铁酸钾反应的离子方程式:_________________________。
(2)若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________ mol。
(3)低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),原因_______________________________________________________________________。
(4)已知K2FeO4能水解产生Fe(OH)3用作净水剂,请写出水解的离子方程式___________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.同主族元素氢化物的稳定性,自上而下逐渐增强
B.电子结构相同的微粒,它们的化学性质亦相同
C.元素Si、P、S、C1最高价含氧酸的酸性依次增强
D.同周期的短周期元素自左而右原子半径依次增大
查看答案和解析>>
科目: 来源: 题型:
【题目】CO(g)和H2O(g)以1 : 2体积比分别通入到体积为2 L的恒容密闭容器中进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:

下列说法不正确的是
A. 从实验数据分析,该反应的正反应是吸热反应
B. 实验A中,在0~10min内,以v(H2)表示的反应速率大于0.013mol(L·min)-1
C. 从生产效益分析,C组实验的条件最佳
D. 比较实验B、C,说明C实验使用了更高效的催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】卤代烃可以与金属反应,形成金属有机化合物。其中最负盛名的有机镁试剂,它是由法国化学家格利雅(V.Grignard)于1901年发现的,故称格氏试剂。它的制法为RX + Mg![]() RMgX ,RMgX与其他物质(如卤代烃、醛等)反应可以实现碳链的增长,得到烃、醇、羧酸等多种有机化合物。如:RMgX+R,CHO →
RMgX ,RMgX与其他物质(如卤代烃、醛等)反应可以实现碳链的增长,得到烃、醇、羧酸等多种有机化合物。如:RMgX+R,CHO → 。用乙烯和适当的无机物合成乙酸异丁酯
。用乙烯和适当的无机物合成乙酸异丁酯 ![]() 的过程如下(反应条件没有列出):
的过程如下(反应条件没有列出):

试回答:
(1)上述过程中,属于或含加成反应的是___________(填反应序号),并写出下列指定物质的结构简式:C:______________E:_______________F:_______________。
(2)反应②的化学方程式______________________________________________。
(3)反应⑦的化学方程式 _____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】1,2二溴乙烷可作汽油抗爆剂的添加剂,常温下是无色液体,密度是2.18克/厘米3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。请填写下列空白:

(1)烧瓶a中发生的是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速升高到170℃,否则容易产生副反应。请你写出乙醇的这个消去反应方程式:_______。
(2)写出制备1,2二溴乙烷的化学方程式:_________________________________。
(3)安全瓶b可以以上倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:_______________________________________。
(4)容器c中NaOH溶液的作用是:_________________________________。
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因__________。
(6)e装置内NaOH溶液的作用是___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实与平衡移动原理无关的是
A. 向含酚酞的Na2CO3溶液中滴加BaCl2溶液,红色变浅
B. 加热MgCl2·6H2O固体最终得到Mg(OH)Cl
C. 将FeS2矿石粉碎更有利于焙烧制备SO2气体
D. NO2气体经过冷凝和加压成无色液体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com