
科目: 来源: 题型:
下列各组离子在碱性条件下能大量共存,且在强酸性条件下能发生氧化还原反应的是
A. Ca2+、Al3+、SO![]() 、Cl— B. K+、Na+、SO
、Cl— B. K+、Na+、SO![]() 、NO
、NO![]()
C. Na+、K+、NO![]() 、SO
、SO![]() D. NH
D. NH![]() 、Na+、Cl—、CO
、Na+、Cl—、CO![]()
查看答案和解析>>
科目: 来源: 题型:
下列叙述中完全正确的一组是
①常温常压下,1 mol甲基(—CH3)所含的电子数为10NA
②由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.2NA
③在标准状况下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA
④常温常压下,16 g O3所含的原子数为NA
⑤1 mol C10H22分子中共价键总数为31 NA
⑥1 mol Cl2发生反应时,转移的电子数一定是2 NA
⑦标准状况下,22.4 L水中含分子数为NA
A.①②③④⑤ B.②③④⑤⑥ C.②④⑤ D.②③④⑤
查看答案和解析>>
科目: 来源: 题型:
下列有关电子云和原子轨道的说法正确的是
A. 原子核外的电子象云雾一样笼罩在原子核周围,故称电子云
B. s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C. p能级的原子轨道呈纺锤形,随着能层的增加,p能级原子轨道也在增多
D. 与s电子原子轨道相同,p电子原子轨道的平均半径随能层的增大而增大
查看答案和解析>>
科目: 来源: 题型:
化学与生活密切相关,下列有关说法正确的是 ( )
A.煤经气化和液化两个物理变化过程,可变为清洁能源
B.糖类、蛋白质、油脂都属于天然高分子化合物
C.维生素C具有还原性,在人体内起抗氧化作用
D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
查看答案和解析>>
科目: 来源: 题型:
如图3,装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电时的化学方程式为:
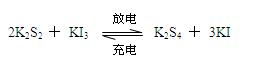
装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是( )
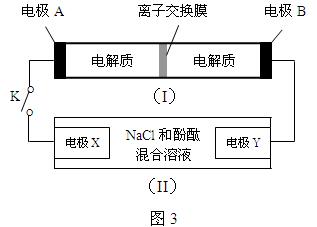
A.电极A上发生的反应为:2S22- - 2e- === S42-
B.K+从右到左通过离子交换膜
C.电极X上发生的反应为:2Cl-- 2e- === Cl2↑
D.当有0.1 mol K+通过离子交换膜,Y电极上产生2.24 L气体(标准状况)
查看答案和解析>>
科目: 来源: 题型:
下列有关实验的叙述中正确的是
A.用烧杯给液态物质加热时,不用垫石棉网
B.加热蒸干AlCl3溶液得到Al2O3固体
C.在用托盘天平称量固体药品时,药品放在右盘上
D.如果未知溶液中滴加BaCl2溶液有白色沉淀生成,证明原溶液中一定含有
SO42—离子
查看答案和解析>>
科目: 来源: 题型:
向某盐溶液中滴加Ba(NO3)2溶液和过量的稀盐酸,有白色沉淀生成, 则原溶液可能是( )
A. KNO3溶液 B. CaCl2溶液 C. Na2SO3溶液 D. Na2CO3溶液
查看答案和解析>>
科目: 来源: 题型:
在由铜锌组成的原电池(电解质是稀硫酸)中,有位同学在铜电极收集到了标准状况下22.4L的气体,
(1) 铜锌原电池的总反应的离子方程式为:________________________________________________________________________
(2) 铜电极产生标准状况下22.4L气体的过程中有多少克的锌溶解?
查看答案和解析>>
科目: 来源: 题型:
对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是( )
4NO(g)+ 6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增大容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
科目: 来源: 题型:
硫酸是工业生产中一种重要的化工产品,我国工业生产硫酸的主要方法是接触法,主要原料为黄铁矿,请回答下列问题:
(1)已知煅烧黄铁矿的化学方程式为 4FeS2 + 11O2 ![]()
该反应中氧化剂和氧化产物之比为 ;标准状态下得到4.48升SO2 时,一共转移了 mol e- 。(每空3分)
(2)已知温度、压强对SO2平衡转化率的影响如下表所示:根据上表回答,SO2转化到SO3的
最佳反应条件是 。(每空2分)
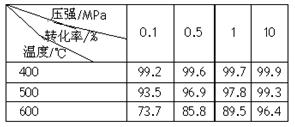
A.400-500℃ 0.1 MPa B.400℃ 10 MPa
C.500℃ 10 MPa D.400-500℃ 1 MPa
(3)在一定条件下,1mol SO2完全转化成SO3气体时放出热量为Q1 KJ,写出该反应的热化学方程式: 。若在该条件下将2 mol SO2 放入一定容积的密闭容器中,一段时间后测得反应放出热量为Q2 KJ,则此时SO2的转化率为 (用含Q1、Q2代数式表示)。(每空2分)
(4)市售浓硫酸的密度是1.84 g / cm3、质量分数为98 % ,若用H2SO4· XH2O来表示这种浓硫酸,则X为 。(每空2分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com