
科目: 来源: 题型:
下列表述中正确的是
A.任何能使熵值增大的过程都能自发进行
B.增大反应物的量,一定会加快正反应速率,使平衡向正反应方向进行
C.化学平衡发生移动,平衡常数不一定发生变化
D.反应物的转化率减少,平衡一定向逆反应方向移动
查看答案和解析>>
科目: 来源: 题型:
在体积可变的容器中发生反应N2 + 3H2 ![]() NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是
NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多
D.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.Cu(s)+2H2O(l)===2Cu(OH)2 (s)+H2(g),该反应可通过右图装置来实现
B.在体积可变的密闭容器中进行反应:CaCO3(s) ![]() CaO(s)+CO2(g)达到平衡后压缩体积,则v(正)、v(逆)均增大,平衡向逆反应方向移动
CaO(s)+CO2(g)达到平衡后压缩体积,则v(正)、v(逆)均增大,平衡向逆反应方向移动
C.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH<0,由该反应可知物质能量关系一定符合:E [ZnSO4(aq)] < E [CuSO4(aq)]
D.在密闭容器中进行反应:HI(g) ![]()
![]() H2(g)+
H2(g)+![]() I2(s)ΔH=-26.5 kJ·mol-1,,则充入1 mol HI,达到平衡后放出26.5 kJ的热量
I2(s)ΔH=-26.5 kJ·mol-1,,则充入1 mol HI,达到平衡后放出26.5 kJ的热量

查看答案和解析>>
科目: 来源: 题型:
关于下列三个反应的说法正确的是
①101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
②2H2O(g) ===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
③稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
A.碳的燃烧热的数值等于110.5 kJ·mol-1 B.H2的热值为142.9kJ·g-1
C.10mL0.1mol·L-1的H2SO4溶液和5mL 0.1mol·L-1NaOH溶液混合,中和热小于57.3 kJ/mol
D.常温常压下,反应①一定能自发进行
查看答案和解析>>
科目: 来源: 题型:
温总理在十届全国人大四次会议上所作的“政府工作报告”中指出:“抓好资源节约,建设环境友好型社会”,这是我国社会及经济长期发展的重要保证。你认为下列行为中有悖于这一保证的是
A.开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料
B.将煤进行“气化”和“液化”处理,提高煤的综合利用效率
C.研究采煤、采油新技术,提高产量以满足工业生产的快速发展
D.实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle)
查看答案和解析>>
科目: 来源: 题型:
㈠下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,请在下面的虚线框中用实线画出周期表的上边框,并画出金属与非金属的分界线。
㈡.(7分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
(1)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为__________;实验室制取该化合物的化学方程式 _________________________
(2)元素G在元素周期表中的位置____________________
(3)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的________(填字母序号)元素组成的,用化学方程式表示吸收原理:
__________________。飞船中消耗1mol该化合物转移电子的物质的量为__________
(4)飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为________。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;②![]() 、
、![]() 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1) HmDm的电子式___________________。
(2) ![]() 、
、![]() 的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
(3) 将E的单质通入A与D形成的化合物的水溶液中,在常温下反应的离子方程式为:
_____________________________________。
(4) 常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液按体积比1:2混合,写出该反应的离子方程式 。该溶液的溶质含有的化学键类型是
(5) 在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。
![]()
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
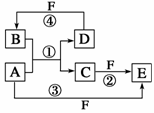 (1)若A为短周期金属单质,D为短周期非金属单质,且所
(1)若A为短周期金属单质,D为短周期非金属单质,且所
含元素的原子序数A是D的2倍,所含元素的原子最外层
电子数D是A的2倍,F的浓溶液与A、D反应都有红棕
色气体生成,则A的原子结构示意图为________,反应④的
化学方程式为____________________________________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,其离子方程式是_____________________________________________,
用电子式表示化合物B的形成过程:_______________________________。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素
同周期,则反应①的化学方程式为___________________________________。
查看答案和解析>>
科目: 来源: 题型:
I、表中①~⑥为部分短周期元素的化合价及原子半径
| 元素性质 | 元素编号 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 原子半径/nm | 0.102 | 0.110 | 0.074 | 0.075 | 0.071 | 0.099 |
| 最高化合价 | +6 | +5 | +5 | +7 | ||
| 最低化合价 | -2 | -3 | -2 | -3 | -1 | -1 |
II、B与C两元素可形成化合物CB2、CB3,二者均可用于制备化合物甲
III、A与B两元素可形成化合物AB、AB2,二者均可用于制备化合物乙。
A、B、C均为上表中的元素,甲、乙为中学常见强酸。
请回答下列问题
(1)写出B元素位于周期表中的位置__________________
(2)A元素气态氢化物的结构式为_____,写出上述元素形成的最稳定的氢化物的电子式____
(3)下列关于物质甲、乙的说法中正确的是__________(填字母)
a.二者的浓溶液在常温时均可用铁制容器贮存
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.二者的浓溶液在常温时均与铜反应 d.二者的稀溶液均具有强氧化性
(4)请写出工业上由CB2制备CB3的化学方程式___________________________。写出工业生产强酸乙的过程中制备化合物AB的化学方程式______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com