
科目: 来源: 题型:解答题
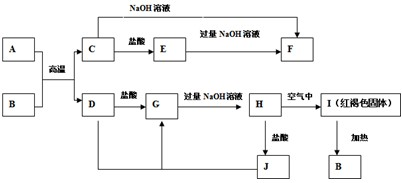
查看答案和解析>>
科目: 来源: 题型:单选题
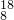 O)是氧的一种同位素,称为重氧.最近,兰州近代物理研究所研制出我国首批重氧气,可用符号18O2表示.重氧与普通氢组成的“水”称为重氧水.下列说法正确的是
O)是氧的一种同位素,称为重氧.最近,兰州近代物理研究所研制出我国首批重氧气,可用符号18O2表示.重氧与普通氢组成的“水”称为重氧水.下列说法正确的是查看答案和解析>>
科目: 来源: 题型:解答题
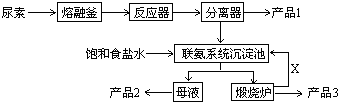 三聚氰胺(化学式:C3N6H6)是一种非食品类的重要有机化工原料,广泛用于塑料、造纸、建材等行业.下图是我国科技工作者研制的以尿素为原料生产三聚氰胺的工艺--“常压气相一步法联产纯碱新技术”:
三聚氰胺(化学式:C3N6H6)是一种非食品类的重要有机化工原料,广泛用于塑料、造纸、建材等行业.下图是我国科技工作者研制的以尿素为原料生产三聚氰胺的工艺--“常压气相一步法联产纯碱新技术”: C3N6H6+6NH3+3CO2
C3N6H6+6NH3+3CO2查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
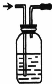 为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验:
为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验: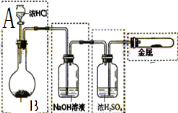 ______
______查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com